【综述背景】
基于丰富的钠储量及与锂离子电池相似的工作机制,钠离子电池被认为是后锂时代能源细分市场最有前景的电池技术之一。在过去的二十年里,钠离子电池电解质的探索与设计,普遍借鉴“固体电解质界面膜(SEI)”理论以优化电解质组分。然而,许多实验现象并不能完全用 SEI 理论解释。目前,电解质溶剂化结构和电极/电解质界面行为最近受到了极大关注,并用以解释优化的性能。然而,溶剂化结构本质抽象,目前对其微结构的形成原因以及其与宏观电化学性能的构效关系,缺乏深入理解。因此,梳理和解析与溶剂化行为相关的科学问题,提出溶剂化结构的设计准则对金属离子电池(包括锂、钠离子电池)快速、稳健的发展,具有十分重要的科学及实际应用意义。
【综述介绍】
近日,阿卜杜拉国王科技大学(KAUST)Husam N. Alshareef教授与中科院长春应化所明军研究员合作,在国际知名期刊《Advanced Science》上发表综述性论文“Electrolyte Solvation Structure Design for Sodium Ion Batteries”。论文以钠离子电池为例,分析了电解液中阳离子溶剂化结构形成的驱动力(配位键,氢键和偶极相互作用)以及相关的几何构型、热力学参数等。其次,通过建立界面模型,阐明了阳离子溶剂化行为与电化学性能之间的构效关系,系统地概述了包括弱配位阴离子盐的开发、阴离子受体、多元溶剂以及浓缩电解质等相关应用实例。最后,介绍了应用于溶剂化行为研究的谱学分析和理论模拟方法。该综述对于“哪些因素影响溶剂化结构”以及“溶剂化结构如何影响电化学性能”等关键科学问题给出了新的理解和思考。

溶剂化行为分析及其对电化学性能的影响。
【内容表述】
- 溶剂化结构形成的驱动力:配位键,偶极作用和氢键
(1)配位键,作为一种典型的短程相互作用力,被认为是形成钠离子溶剂化结构的主要原因。通过原子核和电子对的静电引力,配位键表现出与共价键相似的高强度。钠离子在失去最外层电子后具有空的 2s 轨道,而一些强电子供体有机溶剂分子能够提供孤电子对如己二腈。因此,配位键是可能存在于钠离子与溶剂分子之间。在配位键电子共享的基础上,溶剂提供孤电子对的能力决定了配位键的强度。换言之,有机溶剂的路易斯碱性决定了配位键的强度,较高的路易斯碱性导致更紧密的相互作用。此外,配位键通常存在于基于各种弱配位阴离子的钠盐中。由于吸电子基团的存在,阴离子上的电子离域导致钠离子和阴离子之间的配位键强度显著减弱。基于此,可以通过选择不同的吸电子基团来改变配位键的形成能力,从而改变阴离子的供体数量,进而改变电子离域的程度。(2)氢键,是一种大家较为熟悉的短程作用力,也被认为可能存在与金属盐和有机溶剂之间,特别是对于具有至少一对孤对电子的氟化离子或物种(三丁胺、双(草酸根)硼酸盐)。研究者观察到与这些盐与溶剂氢原子(例如,PC 中丙烯基的氢原子)之间的强氢键相互作用。(3)偶极相互作用,本质上是静电相互作用。它来源于相邻正负电荷中心之间的静电吸引或排斥,在各种电解质中相当普遍。在钠离子电池所使用的质子惰性溶剂中,偶极相互作用的强度与溶剂的介电常数强烈相关。同时也可以通过偶极矩来描述常见的质子惰性溶剂的偶极强度,见下图1. 根据势能计算公式可知,静电相互作用取决于溶剂分子的偶极矩和键长、键角。因此,该相互作用可以通过两种方法进行调节。第一种方法,加强或削弱分子的偶极效应。例如,用电负性更强的氟原子代替碳原子会导致相邻氧原子上的电子密度降低,从而削弱电负性电荷中心。第二种方法,调节溶剂分子和钠离子之间的距离。溶剂分子的大小直接影响空间电阻,进而扰动范德华键长。(关于这三种相互作用力在钠离子电池中细节的讨论请查阅原文,此处不做赘述)

图1. (a-c)配位键,氢键和偶极相互作用的示意图。(d) 常见的质子惰性溶剂的偶极矩示意。
2.溶剂化结构的几何构型以及热力学参数
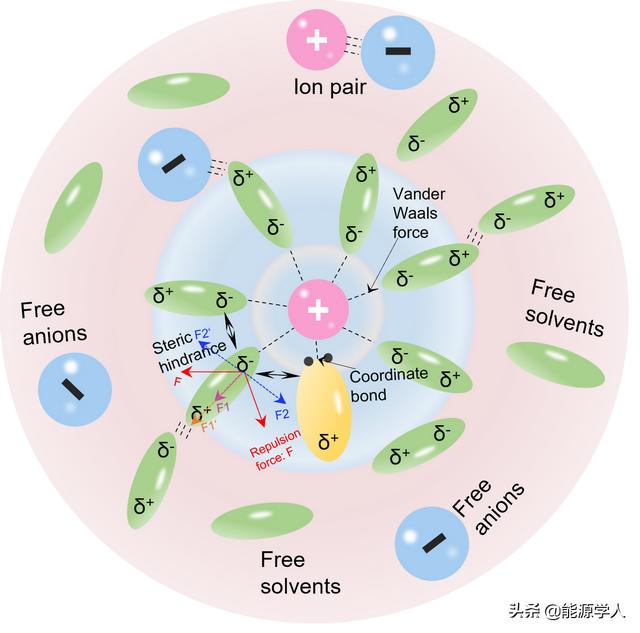
溶剂化层的简化模型可考虑阳离子为中心,而忽略阳离子和阴离子之间的相互作用(图2)。该模型绘制为球体,将溶剂视为包裹溶质离子的连续且均匀的介质。如图所示,具有两个溶剂化层,分别是第一溶剂化层和第二溶剂化层。由于偶极子(溶剂分子A)与阳离子产生的强静电力,形成了第一个溶剂化层(由内圈显示)。此外一些具有广泛路易斯碱度的溶剂分子也表现出与阳离子的强配位相互作用以形成配位键。不过,作者在此认为第一溶剂化中主要存在的相互作用是偶极相互作用而非配位键。静电力和配位键之间的作用协同,使得阳离子和溶剂分子之间的吸引和排斥作用达到平衡,从而形成第一溶剂化壳层。值得指出的是,一些文献中提到的“配位溶剂化层”与第一溶剂化层是基于相同的概念。阳离子和溶剂分子之间的强烈相互作用和紧密连接导致阳离子伴随第一溶剂化层移动,而非孤立迁移。与第一个溶剂化层相比,第二个溶剂化层表现松散。它包括部分受到远程偶极作用影响的溶剂分子,被阳离子吸引的溶剂分子,甚至是离子对。同样,游离的溶剂分子和游离阴离子也包含在第二溶剂化层中。需要注意的是,此处提出的溶剂化结构是基于离子对可以被溶剂分离的假设。阳离子的溶剂化结构会被溶剂的介电常数以及阳离子与阴离子之间的相互作用(晶格能)所影响。
【溶剂化结构的几何参数】:(1)配位数,代表第一溶剂化层中阳离子周围的溶剂分子数。(2)平均键长,表示溶剂中心钠离子和溶剂分子电荷中心之间的距离。(3)空间位阻,可以理解为在第一溶剂化层中相邻溶剂分子之间由于偶极子指向同一方向而产生的排斥作用。第一溶剂化层中,大的溶剂分子尺寸或者高配位数将导致大的空间位阻,从而增加阳离子和溶剂之间的键长。
【溶剂化结构的热力学参数】:(1)结合能(ΔEb),反映了阳离子和溶剂分子之间相互作用的强度。可以根据溶剂化络合物与构成络合物的成分(溶剂分子 (SM) 和Na )之间的能量差异计算:
ΔEb = E(complex) - (n·E(SM) E(Na ))
(2)溶剂化自由能(ΔGsol),是指在一定的热力学过程中,降低的内能可以转化为外功的部分。对于ΔGsol<0,溶剂化过程更容易发生。对于溶剂化过程,ΔGsol 可以使用以下等式计算:
ΔG(sol) = G(complex) - (n·G(SM) G(Na ))
(3)LUMO 和 HOMO 能级 (LUMO/HOMO),表示溶剂化Na 溶剂的最高占据分子轨道 (HOMO) 和最低未占据分子轨道 (LUMO)。