同位素(英语:Isotope)是某种特定化学元素之下的不同种类,同一种元素下的所有同位素都具有相同原子序数,质子数目相同,但中子数目却不同。这些同位素在化学元素周期表中占有同一个位置,因此得名。
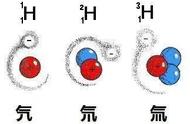
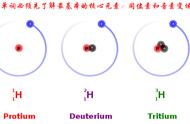
例如:氢有三种同位素,P氕pie(Protium)、D氘dao(Deuterium又叫重氢)、T氚chuan(Tritium又叫超重氢)它们原子核中都有1个质子,但是它们的原子核中分别有0个中子、1个中子及2个中子,所以它们互为同位素。其中,氕的相对原子质量为1.007947,氘的相对原子质量为2.274246,氚的相对原子质量为3.023548,氘几乎比氕重一倍,而氚则几乎比氕重二倍;再比如碳有多种同位素,12C、13C和 14C(有放射性)等。
同位素是同一元素的不同原子,其原子具有相同数目的质子,但中子数目却不同。例如:氕、氘和氚,它们原子核中都有1个质子,但是它们的原子核中却分别有0个中子、1个中子及2个中子,所以它们互为同位素。
同位素具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学性质几乎相同(氕、氘和氚的性质有些微差异),但原子质量或质量数不同,从而其质谱性质、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。同位素的表示是在该元素符号的左上角注明质量数(例如碳14,一般用14C来表示)。
在自然界中天然存在的同位素称为天然同位素,人工合成的同位素称为人造同位素。如果该同位素是有放射性的话,会被称为放射性同位素。每一种元素都有放射性同位素。有些放射性同位素是自然界中存在的,有些则是用核粒子,如质子、a粒子或中子轰击稳定的核而人为产生的。
历史
弗雷德里克·索迪借由衰变链分析,在1912年证实同位素存在。
约瑟夫·汤姆孙在1913年首次发现稳定元素同位素的证据。弗朗西斯·阿斯顿通过实验,证明了氖的两种同位素的存在。
基本性质
同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。同位素的表示是在该元素符号的左上角注明质量数(质子数 中子数),左下角注明质子数。 例如碳14,一般用14C而不用C-14。
自然界中许多元素都有同位素。同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性。
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。自然界中,各种同位素的原子个数百分比一定。
同位素是指具有相同核电荷但不同原子质量的原子(核素)。在19世纪末先发现了放射性同位素,随后又发现了天然存在的稳定同位素,并测定了同位素的丰度。大多数天然元素都存在几种稳定的同位素。同种元素的各种同位素质量不同,但化学性质几乎相同。
自19世纪末发现了放射性以后,到20世纪初,人们发现的放射性元素已有30多种,而且证明,有些放射性元素虽然放射性显著不同,但化学性质却完全一样。
研究
1910年英国化学家 弗雷德里克·索迪(Frederick Soddy,1877年9月2日-1956年9月22日)提出了一个假说,化学元素存在着相对原子质量和放射性不同而其他物理化学性质相同的变种,这些变种应处于周期表的同一位置上,称做同位素。不久,就从不同放射性元素(铀和钍等)得到一种铅的相对原子质量是206.08,另一种则是208。1897年英国物理学家J.J.汤姆逊(约瑟夫.约翰.汤姆逊)发现了电子,1912年他改进了测电子的仪器,利用磁场作用,制成了一种磁分离器(质谱仪的前身)。当他用氖气进行测定时,无论氖怎样提纯,在屏上得到的却是两条抛物线,一条代表质量为20的氖,另一条则代表质量为22的氖。这就是第一次发现的稳定同位素,即无放射性的同位素。当F.W.阿斯顿制成第一台质谱仪后,进一步证明,氖确实具有原子质量不同的两种同位素,并从其他70多种元素中发现了200多种同位素。
到目前为止,已发现的元素有109种,只有20种元素未发现稳定的同位素,但所有的元素都有放射性同位素。大多数的天然元素都是由几种同位素组成的混合物,稳定同位素约有300多种,而放射性同位素竟达约2800种以上。
1932年提出原子核的中子——质子理论以后,才进一步弄清,同位素就是一种元素存在着质子数相同而中子数不同的几种原子。由于质子数相同,所以它们的核电荷和核外电子数都是相同的(质子数=核电荷数=核外电子数),并具有相同电子层结构。因此,同位素的化学性质是相同的,但由于它们的中子数不同,这就造成了各原子质量会有所不同,涉及原子核的某些物理性质(如放射性等),也有所不同。一般来说,质子数为偶数的元素,可有较多的稳定同位素,而且通常不少于3个,而质子数为奇数的元素,一般只有一个稳定核素,其稳定同位素从不会多于两个,这是由核子的结合能所决定的。
-------------
分割线
现在我来讲一点进阶的知识吧。
一大堆质子和中子凑在一起构成了原子核(最简单氢元素的同位素的氕是只有一个质子而不包含中子的)。质子都带正电荷 1,中子是电中性也就是电荷为零,而想要克服两个相同点和的排斥力能强行把两个质子束缚在原子核内就需要很大的能量,这比电磁力要大得多。科学家们因此知道了还有一种更强大的力量没有被发现,这就是四大基本力学中的强相互作用力,其携带粒子为胶子,顾名思义,能把质子中子等粘合在一起,作用范围只在原子核范围内。强相互作用力(四大原力之首)大概是电磁力(排老二)的100倍。
但这和同位素有啥关系呢?
当然了,因为强相互作用力也有极限的,简单理解就是,当强力hold不住那么多核内粒子的时候就会损失中子,所以在强力极限允许的范围内才会有稳定的同位素,实验室里面人工合成但瞬间又衰变的同位素就是因为原子核实在hold不住这么多核内粒子了。这里面其实还有弱相互作用力的作用,若相互作用会让质子和中子衰变并放出高能粒子,这也是产生放射性的原因。原子核内部是强力、电磁力、弱力都互相抗衡和牵制的的场所,充满了神奇,当然引力也有参与,夸克是目前已知的唯一一个可以同时参与四种相互作用的基本粒子,会有夸克禁闭,渐近自由,色荷转变,电荷抵消等等一系列有意思的现象,当然这是另外一个比较有意思的话题了,以后会展开讨论。
另外还要感叹一下,最让我觉得厉害的是元素周期表里面氕氘氚的翻译,三个笔画对应三个同位素特别形象,而且还兼顾了发音,偏旁部首也是气字对应。所以就顺便查了一下资料,才发现历史原来这么有趣,天才不应被忘记。
元素周期表中的汉字,许多是清代化学家徐寿(1818——1884)确定下来的。但“确定”不等于造字。徐寿确实造了一批字,比如氢、钙等字。可是,他用的大部分的字,其实是来自于中国古代就有的一些金字旁、火字旁的生僻字(很多是朱元璋为了给儿孙们起名字而硬造出来的),徐寿不过是“废物利用”而已。
好了,今天就说到这里,喜欢的点个赞哦