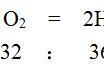在初中化学的学习中,学生们对于计算题的学习和理解一直是一个难点。以下是总结的关于计算的学习方法,希望能对正在攻克难关的同学有所帮助。
一、牢固掌握化学计算的基础知识。基本概念、原理和元素化合物是进行化学计算的依据。若概念不清,原理不明,物质的变化规律不十分明确,就会把题做错。

如式量这个概念它只表示一个化学式如H2O的式量为18,5H2O中水的式量仍是18而不是90,再如A+2B=C+2D中已知C和D的式量比为22:9,若生成4克C同时还有多少克D生成。其C和D的质量比一定是22:2×9=22:18然后再进行有关计算。
如把C和D的质量比仍按22:9进行计算就是错误的,反映出你对式量的概念还不清楚。
二、掌握并运用好解题步骤解题分为三步即审题、析题、解题。
审题就是阅读原题,理解题意了解特点和类型弄清已知和未知,要防止不看全题断章取义,粗心大意。

析题就是剖析原题,在审题基础上弄清关键词语的含义,对众多事实或复杂现象进行分析、综合、挖出隐含条件及内在联系找出突破口,从而确立解题思路和方法。这是解题中最关键的一步。
解题是在析题的基础上进行的用已知求出未知得出正确结果。
三、注意解题规律和思想,掌握解题技巧要善于从典型题的分析中找出其特点、规律和思路,能举一反三,要做一题知多题从而不断提高自己的解题能力。
质量守恒定律这是初三化学方程式综合计算题和用字母表示的化学方程式的计算题中的主要思路。
如a克KClO3和b克MnO2加热完全反应后剩余固体质量为c克生成O2多少克?运用质量守恒定律可求出O2质量是a克+b克-c克。再如已知KClO3中氧的质量分数为39.2%,KMnO4中氧的质量分数的40.5%,若各取100克加热完全分解后哪种物质产生氧气多。
表面上看KMnO4中氧元素的质量分数比KClO3中氧元素的质量分数要大,但要是认真分析抓住完全反应这个关键词语,从化学方程式可以看出KClO3中虽含氧元素的质量略比KMnO4低,但它的氧元素全部都转化为O2,而KMnO4中的氧元素只是部分转化为O2,近而得出是KClO3生成的O2多。

再如有FeSO4和Fe(SO4)3的混合物测得混合物中S元素的质量分数为a%,则混合物中Fe的质量分数是多少?
此题按元素质量分数求可做出来但很繁索,可以巧解。即从物质宏观元素巧妙地过度到微观原子个数来找出质量比从而可以进行计算。
无论FeSO4或Fe2(SO4)3中“SO4”是不变的所以: S : O原子个数比 1 :4,质量比 32 : 64 ,1 : 2 设混合物的质量为1,已知S元素质量为a%,则O元素的质量为2a%,那“SO4” 的总质量为3a%所以Fe元素的质量分数为1-3a% 。