热力学作为物理学的一个分支,关注的是能量的转换与物质的状态变化。在热力学的四大定律中,热力学第一定律描述了能量守恒的概念,并将其应用于热力学过程。本文讨论该定律背后的物理含义,及其在工程、化学、生物等领域的应用。
## 热力学第一定律的物理内涵
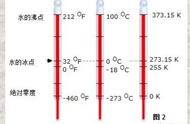
热力学第一定律描述能量守恒的原则,即在一个封闭系统中,能量既不能被创造也不能被毁灭,能量只能从一种形式转换为另一种形式,或者从一个物体传递到另一个物体。
能量守恒是自然界最基本的原则之一。实际上,热力学第一定律是牛顿经典力学能量守恒定律的广义形式,它包含了内能(包括分子微观动能与势能的总和)变化的概念,并且第一次明确地将热视为能量的一种形式。
## 热力学第一定律在实际中的应用
### 工程领域
在工程领域,尤其是热能工程领域,热力学第一定律是计算发电效率、制冷循环、热泵效率等的基础。例如,汽轮机的工作原理:通过高温高压的蒸汽对汽轮机叶片做功,转化为机械能,最终通过发电机转换成电能。在这个过程中,热能通过做功转化为机械能和电能,系统内能的变化反映了能量转换的效率。
### 化学反应
化学领域中,热力学第一定律用于分析反应热效应,如吸热反应和放热反应。对于反应热学的研究,实质上是研究反应前后化学物质内能的变化。在设计化学反应器和化学工程过程中,了解反应所需或释放的热量,对于控制反应温度、压力和反应速率至关重要。
### 生物代谢
热力学第一定律同样适用于生物体的代谢过程。生物体在进行新陈代谢时会释放能量,这部分能量来源于食物分子中化学键的断裂和*。生物体吸收的热量和所做的功可用来维持体温、新陈代谢和肌肉活动等生命活动。
### 天体物理学
天体物理学中,恒星如太阳通过核聚变不断释放巨大的能量,这个过程也遵循能量守恒定律。核聚变过程中,部分质量转化为能量,释放为光和热,这一现象由著名的质能等价公式 E=mc² 提供理论支持。
## 热力学能量转换的实例
我们将热力学第一定律应用于一个典型的热力学系统——汽化冷却。一个压力容器内充满了液态水,随着温度升高,水逐渐汽化成蒸汽。在这个汽化过程中,如果系统是封闭的,液态向气态的相变需要吸收大量热量,这部分热量转变成了水分子的内能。系统内能的增加,表现为水分子速度的增加(即温度的升高)以及水分子间势能的增加(由液态到气态间隔距离的增加)。
这一过程在日常生活中的蒸锅和工业上的锅炉中得到应用。通过控制压力和温度条件,蒸汽的产生和利用都可进行优化以达到更高的能量利用效率。
## 热力学第一定律的局限性
尽管热力学第一定律提供了能量守恒的基础框架,但它并没有指出不同形式的能量转换是如何进行的。例如,它并未解释为什么一些能量转换过程在实际操作中不可逆,或者能量转换效率低下的微观机制。
此外,热力学第一定律的形式化表述未涵盖非平衡状态的热力学过程,例如涡流损耗、湍流和爆炸等现象。这些过程的精细描述需要依赖于非平衡态热力学的进一步发展。
热力学第一定律作为物理学中能量守恒概念的体现,对于理解和设计能量转换与物质状态改变的过程至关重要。从物理学角度来看,该定律不仅本身具有丰富的内涵,而且在工程、化学、生物学及天体物理学等广泛领域拥有深远的实际应用价值。
虽然热力学第一定律揭示的能量守恒定律是普适的,但特定情境下的能量转换机制仍需依赖于热力学的其他定律以及更深入的物理理论进行探讨。未来,人类对宇宙能量转换规律的理解,将依旧以热力学定律为基石,不断追求那些未知的、更加精确的物理描述。