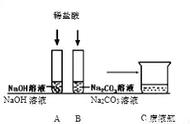
导语:高中化学氧化还原反应的应用是比较广泛的,反应条件也各不相同。氧化还原反应的最大特点就是在反应过程中,参与反应元素的化合价会发生升降变化。电化学原电池和电解池是氧化还原反应在高中化学中比较常见的应用,也是高考化学每年必考的重点。
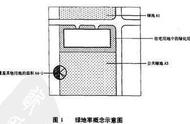
例题:科学家近年发明了一种新型Zn—CO2 水介质电池。电池示意如图,电极为金属Zn和选择性催化材料,放电时,室温气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。

下列说法错误的是

解析:本题考查三个知识点:
一是氧化还原反应的基本原理,二是在电池放电过程中,正、负两级分别发生的反应和化学方程式,三是在电池充电过程中,阴、阳两个电极分别发生的反应和化学方程式,关键是先确定哪边区域是负极(阴极),哪边区域是正极(阳极)。
解:由图可知,实线代表放电过程,适用原电池工作原理,虚线代表充电过程,适用电解池工作原理。

在充电过程中,在右边电极区域,H2O变为O2,氧离子被氧化,而充电过程中,阳极区域要发生氧化反应,因此,右边电极区域在充电过程中为电池的阳极,左边电极区域为电池的阴极。