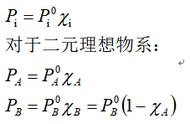高中物理题目经常出现一定质量的气体,如果气体质量发生了变化,那么理想气态方程也就失效了。
例:农村常用来喷射农药的压缩喷雾器的结构如图所示,

A的容积为7.5L,装入药液后药液上方空气的压强为10⁵Pa,体积为1.5L,关闭阀门K,用打气筒B每次打进10⁵Pa的空气0.25L。则:
(1)要使药液上方气体的压强为4×10⁵Pa,打气筒活塞应打几次?
(2)当A中有4×10⁵Pa的空气后打开阀门K可喷射药液,直到不能喷射时,A容器剩余多少体积的药液?
解法一:回归收集法
(1)放气题:既要考虑留在容器内的气体A,也要考虑跑到容器外的气体B,A和B是两团气体,两个研究对象,要分别使用气体实验定律.
(2)充气题:既要考虑一开始就在容器内的气体A也要考虑后来充入容器的气体B,A和B同样划分为两个研究对象,分别使用气体实验定律.
(1)先虚拟一个等压过程。(等效过程)
把待充气体压强状态变为4×10⁵Pa,设体积为V,根据玻意耳定律得,
1×10⁵Pa×N·0.25L=4×10⁵Pa×V
V=N/16(L)
A容器的压强状态变为4×10⁵Pa,设体积为V′,根据玻意耳定律得,
1×10⁵Pa×1.5J=4×10⁵Pa×V′
V′=1.5/4(L)
V V′=1.5(L)
1.5/4 N/16=1.5
N=18
(2)当内外气压相等时药液不再喷出此时P₃=1×10⁵Pa,V3=?,由玻意耳定律得:p₂V₂=p₃V₃,代入数据计算得出:V₃=6L,剩余药液的体积:△V=7.5L-6L=1.5L
答:(1)要使药液上方气体的压强为4x10⁵Pa打气筒活塞应打18次;
(2)当A中有4×10⁵Pa的空气后打开阀门K可喷
射药液到不能喷射时A容器剩余多少体积的药液为1.5L。
解析:
(1)气体发生等温变化应用玻意耳定律求出打气的次数;
(2)当内外气压相等时药液不再喷出应用玻意耳定律求出空气的体积然后求出剩余的药液。
解法二:理综理想气体状态方程PV=nRT⇒n=PV/RT,充气放气,物质的量总量并不发生变化。
设打气次数为N,物态变化为等温变化。
n₀=p₀v₀/RT=1×10⁵Pa×1.5L/RT
n₁=N·p₁v₁/RT=N·1×10⁵Pa×0.25L/RT
n₂=p₂v₂/RT=4×10⁵Pa×1.5L/RT
n₀ Nn₁=n₂
得到N=18
解法三:道尔顿分压定律
(1)充气后气体压强总为4×10⁵Pa,
原来气体压强不变为1×10⁵Pa,
则充入的气体压强为3×10⁵Pa.
对充入的气体应用玻意耳定律得,
1×10⁵Pa×N·0.25L=3×10⁵Pa×1.5L得到N=18
混合气体的压强,等于各组气体单独存在而占有该容积,且具有混合气体的温度和该组气体的摩尔数时的压强之和,这是道尔顿由实验总结出来的,称为道尔顿分压定律,其表达式为P=∑Pi
值得说明的是,如果我们单独研究混合气体中的某一组气体,对该种气体而言,它仍然遵循理想气体的状态方程和克拉珀龙方程。
例:如图所示,

一太阳能空气集热器,底面及侧面为隔热材料,顶面为透明玻璃板,集热器容积为V.开始时内部封闭气体的压强为p₀,经过太阳暴晒,气体温度由T₀=300K升至T₁=350k.
(1)求此时气体的压强;
(2)保持T₁=350K不变,缓慢抽出部分气体,使气体压强再变回到p₀.求集热器内剩余气体的质量与原来总质量的比值.