考法 有关NA的正误判断
【典例1】(2021年1月浙江选考)设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol NH4F晶体中含有的共价键数目为3NA
B.CH4和C2H4混合气体2.24L(标准状况)完全燃烧,则消耗O2分子数目为0.25NA
C.向100mL 0.10mol·L-1FeCl3溶液中加入足量Cu粉充分反应,转移电子数目为0.01NA
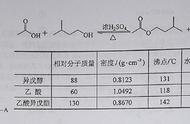
D.0.1 mol CH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目为0.1NA
【详解】A项,NH4F结构中只有铵根中含有4个共价键,则l mol NH4F晶体中含有的共价键数目为4NA,A错误;B项,CH4和C2H4混合气体2.24L(标准状况)的物质的量是0.1mol,由于1mol CH4和C2H4分别完全燃烧消耗氧气的物质的量分别是2mol、3mol,则0.1mol混合气体完全燃烧消耗氧气的分子数目应该介于0.2NA和0.3NA之间,B错误;C项,l00 mL0.10 mol/L FeCl3溶液中铁离子的物质的量是0.01mol,加入足量Cu粉充分反应,铁离子被还原为亚铁离子,则转移电子数目为0.01NA,C正确;D项,乙酸和乙醇的酯化反应是可逆反应,则0.1 mol CH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目小于0.1NA,D错误;故选C。
【答案】C
【典例2】(2020•新课标Ⅲ卷)NA是阿伏加德罗常数的值。下列说法正确的是( )
A.22.4 L(标准状况)氮气中含有7NA个中子
B.1 mol重水比1 mol水多NA个质子
C.12 g石墨烯和12 g金刚石均含有NA个碳原子
D.1 L 1 mol·L−1 NaCl溶液含有28NA个电子
【解析】A项,标准状况下22.4L氮气的物质的量为1mol,若该氮气分子中的氮原子全部为14N,则每个N2分子含有(14-7)×2=14个中子,1mol该氮气含有14NA个中子,不是7NA,且构成该氮气的氮原子种类并不确定,故A错误;B项,重水分子和水分子都是两个氢原子和一个氧原子构成的,所含质子数相同,故B错误;C项,石墨烯和金刚石均为碳单质,12g石墨烯和12g金刚石均相当于12g碳原子,即 =1molC原子,所含碳原子数目为NA个,故C正确;D项,1molNaCl中含有28NA个电子,但该溶液中除NaCl外,水分子中也含有电子,故D错误;故选C。
【答案】C


判断有关阿伏加德罗常数题主要技法
(1)抓“两看”,突破“状态、状况”陷阱
一看“气体”是否处于“标准状况”。
二看“标准状况”下,物质是否为“气体”(如CCl4、H2O、Br2、SO3、酒精、己烷、苯等在标准状况下均不是气体)。
(2)排“干扰”,突破“质量、状况”陷阱
给出非标准状况下气体的物质的量或质量,干扰学生正确判断,误以为无法求解物质所含的粒子数,实际上,此时物质所含的粒子数与温度、压强等外界条件无关。
(3)记“组成”,突破“结构”判断陷阱
①记特殊微粒中质子、中子或电子的数目,如Ne、D2O、18O2、—OH、OH-等。
②记实验式相同的物质,如NO2和N2O4、乙烯(C2H4)和丙烯(C3H6)等。
③记摩尔质量相同的物质,如N2、CO、C2H4等。
④记特殊物质的摩尔质量,如D2O、18O2、H37Cl等。
(4)审“要求”,突破“离子数目”判断陷阱
一审是否有弱酸或弱碱离子的水解。
二审是否指明了溶液的体积。
三审所给条件是否与电解质的组成有关,如pH=1的H2SO4溶液中,c(H )=0.1 mol·L-1,与电解质的组成无关;0.05 mol·L-1的Ba(OH)2溶液中,c(OH-)=0.1 mol·L-1,与电解质的组成有关。
(5)记“隐含反应”,突破“粒子组成、电子转移”判断陷阱
注意可逆反应,如1 mol N2和3 mol H2在一定条件下充分反应后,生成NH3的分子数应小于2NA。再如弱电解质中存在电离平衡,不能完全电离等。
(6)“分类”比较,突破“电子转移”判断陷阱
①同一种物质在不同反应中作氧化剂还是还原剂的判断。
如Cl2和Fe或Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂。
再如Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2反应,Na2O2只作氧化剂。
②量不同,生成物中元素所表现的化合价不同。
如Fe和HNO3反应,Fe不足,生成Fe3 ,Fe过量,生成Fe2 。
③氧化剂或还原剂不同,生成物中元素所表现的化合价不同。
如Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。
④注意氧化还原的顺序。
如向FeI2溶液中通入Cl2,先氧化I-,再氧化Fe2 。