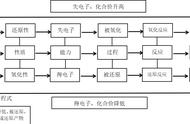
(3) 5S2O 14OH-=4S2- 3S2O42- 7H2O,S2O 4OH-==S2- SO32- 2H2O
(4)S2O 2H2O==H2S H2SO3(或5S2O 7H2O==4H2S 3H2S2O4)
分合法书写较复杂的无机反应化学方程式
在书写较复杂的无机反应化学方程式时,如果盲目书写,会出现写不全或写不对等情况。如果将复杂反应先拆分成若干个熟悉的简单反应,写出其化学方程式,然后再加以合并写出总反应式。
解题关键:根据化学反应原理合理地对复杂反应进行拆分,借助于熟悉的简单的反应方程式合并而成。
例1.过氧化钠的性质有:淡黄色固体、与水或二氧化碳反应、有强氧化性、有漂白性。请根据下列过氧化钠的实验现象,写出有关化学方程式或离子方程式。
①在盛有二氧化硫气体的集气瓶中投入过氧化钠粉末,粉末的颜色由淡黄色转变为白色,该反应的化学方程式是 。
②在氢硫酸溶液中投入过氧化钠粉末,溶液变浑浊,该反应的化学方程式是 。
③在亚硫酸钠溶液中投入过氧化钠粉末,溶液中SO32-被氧化为SO42-,该反应的离子方程式是 。
④在氯化亚铁溶液中投入过氧化钠粉末,溶液中Fe2 被氧化为Fe3 ,同时生成红褐色沉淀,该反应的离子方程式是 。
解析:①模仿CO2与Na2O2反应写出:2SO2 2Na2O2==2Na2SO3 O2,发现还原性较强的Na2SO3还会被O2氧化:2Na2SO3 O2==2Na2SO4;将两式合并相加消去Na2SO3得总反应式:SO2 Na2O2==Na2SO4。
②分开写出两个常见反应的化学方程式:2Na2O2 2H2O==4NaOH O2↑和O2 2H2S==2S↓ 2H2O;合并消去反应式中H2O和O2,写出总反应式:Na2O2 H2S==S↓ 2NaOH。
③分开写出两个常见反应的离子方程式:2Na2O2 2H2O==4Na 4OH- O2↑和2SO32- O2==2SO42-;合并写出总反应式:Na2O2 H2O SO32- ==2Na 2OH- SO42-。
④沉淀是Fe(OH)3由三个反应生成:2Na2O2 2H2O==4Na 4OH- O2↑、Fe2 2OH-==Fe(OH)2↓、4Fe(OH)2 O2 2H2O==4Fe(OH)3;故该反应的离子方程式可以通过消去Fe(OH)2、OH-和部分O2得:4Fe2 4Na2O2 6H2O==4Fe(OH)3↓ 8Na O2↑。
例2.下列离子方程式书写正确的是( )
A.Fe2O3 溶于氢碘酸中:Fe2O3 6H ==2Fe3 3H2O
B.Fe(OH)2 溶于稀硝酸中:Fe(OH)2 2H ==Fe2 2H2O
C.Fe3O4溶于稀硫酸中:Fe3O4 8H ==3Fe3 4H2O
D.CaCO3溶于氯化铁溶液:2Fe3 3CaCO3 3H2O==2Fe(OH)3 3CO2↑ 3Ca2
解析:Fe2O3 溶于氢碘酸,若生成具有较强氧化性的Fe3 离子,可将溶液中还原性的I-离子氧化成I2,即:2Fe3 2I-==2Fe2 I2,与Fe2O3 6H ==2Fe3 3H2O合并消去Fe3 写出总反应式:Fe2O3 6H 2I-==2Fe2 I2 3H2O,故选项A不正确;稀硝酸具有很强的氧化性,遇到还原性物质或离子就能把其氧化,Fe2 会被氧化为Fe3 ,故选项B不正确,正确的离子方程式可按Fe(OH)2 2H ==Fe2 2H2O 和3Fe2 4H NO3-==3Fe3 NO↑ 2H2O两个离子反应的先后顺序思考并写出:3Fe(OH)2 10H NO3-==3Fe3 NO↑ 8H2O;选项C电荷不守恒,不正确,Fe3O4(视为FeO•Fe2O3)中Fe有两种价态,分开写出Fe2O3 6H ==2Fe3 3H2O和FeO 2H ==Fe2 H2O,合并得:Fe3O4 8H ==2Fe3 Fe2 4H2O;选项D可利用氯化铁水解呈酸性,H 溶解CaCO3的反应原理来书写离子方程式,分开两式:

例3.铁的重要化合物在生产生活中应用广泛。FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
解析:红褐色物质Fe(OH)3中的铁元素为 3价,而FeCO3中的铁元素为 2价,必然需要空气中的氧气参与氧化还原反应,FeCO3 要转变为铁的氢氧化物可以视为发生了水解反应,根据上述反应原理可分开写出两个化学方程式:FeCO3 H2O

训练:下列各反应均可以按照分合法的思维并结合有关反应原理写出有关化学方程式,请你练一练。
①氧化亚铁溶于适量的稀硝酸中
②氢氧化铁溶于一定量的氢碘酸中
③氮化镁溶于足量的稀盐酸中(提示:氮化镁遇水可发生水解反应)
④氮化铝(AlN)溶于过量的氢氧化钠溶液中
⑤金属镁溶于饱和氯化铵溶液中(提示:氯化铵溶液水解呈酸性)
⑥氯气通入消石灰的水溶液中
⑦氯化铜溶液中混有少量氯化铁可通过加入氧化铜或氢氧化铜或碳酸铜或碱式碳酸铜等除杂,所涉及的反应原理用化学方程式表示之。
⑧将盛有等体积NO和NO2的混合气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使NO、NO2混合气体完全溶于水中,写出该反应的化学方程式。
⑨已知:氯气可以置换出氨气中的氮。写出过量的氨气与氯气反应的化学方程式。
⑩等物质的量的碳化钙、碳酸氢铵与少量的水充分混合后恰好完全反应,写出有关反应的化学方程式。
应用规律书写新教材中未出现的氧化还原反应
氧化还原反应是高中化学的重要理论之一,应用十分广泛,是每年高考的热点,考查内容主要有氧化还原反应概念和规律及应用、氧化还原反应方程式的书写及配平、氧化性与还原性的判断、电化学知识等,而氧化还原反应方程式的正确书写必须综合应用氧化还原反应规律。当已知氧化产物或还原产物时,可直接写出氧化还原反应方程式(直写法);当不知道氧化产物或还原产物时,可以根据氧化剂合理推测还原产物,根据还原剂合理推测氧化产物,然后再写出氧化还原反应方程式(推理法)。
例1.根据下列框图回答问题:

⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
解析:此题有两个突破口:一是红色金属M是Cu;二是Y遇KSCN溶液显红色,说明Y中含有Fe3 ,故E是Fe。推理出各物质后,可根据有关实验现象和图示信息直接写出有关化学方程式或离子方程式。
⑴蓝色溶液是CuSO4溶液,H2O2作氧化剂,还原产物是H2O,H2SO4提供酸性作用,故可用直写法得配平的化学方程式:Cu H2O2 H2SO4==CuSO4 2H2O。
⑵X溶液酸化后加入KI淀粉溶液,变为蓝色,知必有I2生成,说明X溶液酸化后Fe2 已被空气中O2氧化成Fe3 ,故该变化过程有关反应的离子方程式为:4Fe2 O2 4H ==4Fe3 2H2O; 2Fe3 2I-==I2 2Fe2 。
⑶红色溶液知Y中含有Fe3 ,加KOH生成的Z是Fe(OH)3,Cl2可将Fe(OH)3氧化成K2FeO4,Cl2在KOH溶液中被还原为KCl,故可得配平的化学方程式为:3Cl2 2Fe(OH)3 10KOH==2K2FeO4 6KCl 8H2O。
例2.实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4。试回答:
⑴软锰矿制备K2MnO4的化学方程式是: 。
⑵K2MnO4制备KMnO4的离子方程式是: 。
⑶KMnO4能与热的经硫酸酸化的Na2C2O4反应,该反应的离子方程式是: 。
解析:根据题设信息,⑴、⑵问氧化还原反应的产物均已知,故可用直写法得配平的化学方程式:
⑴3MnO2+KClO3+6KOH