一、物质溶解性的定量表示
1. 溶解度:符号:S,单位:g
(1)固体物质的溶解度是指在一定温度下,该物质在100g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量
(2)对于饱和溶液来说
溶质质量分数 = S ÷ ( S 100 ) ×100%
对于饱和溶液:m(质):m(剂):m(液) = S:100:(S 100)
2. 常温下(20℃)溶解度和溶解性的关系

3. 影响固体物质溶解度的因素
(1)溶质的种类
(2)溶剂的种类
(3)温度
4. 影响气体物质溶解度的因素
(1)溶质的种类
(2)溶剂的种类
(3)温度:温度越高,溶解度越小
(4)压强:压强越大,溶解度越大
5. 溶解度曲线

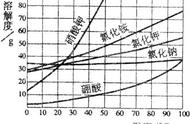
图6-13 几种固体物质的溶解度曲线
(1) P点的意义:t2℃时,甲和乙的溶解度相等,都是30g
(2) N点表示:甲物质的不饱和溶液,乙物质的饱和溶液
(3) 20g甲物质放在50g水中,形成饱和溶液,溶液质量是65g
(4) t1℃时,甲的饱和溶液升温到t3℃时变为不饱和溶液,溶质质量分数不变
(5) t1℃时,丙的饱和溶液升温到t3℃时仍是饱和溶液,溶质质量分数变小
(6) t1℃时,甲、乙、丙的饱和溶液升温到t3℃时,溶质质量分数从大到小的顺序乙>甲>丙(口诀:上山难要平移,下山要坐滑滑梯)
(7) t3℃时,相同质量的甲和乙饱和溶液降温到t1℃时,物质甲析出固体多
(8) t3℃时,甲、乙、丙的饱和溶液溶质质量分数由大到小的顺序:甲>乙>丙
(9) t3℃时,甲、乙、丙的溶解度由大到小的顺序:甲>乙>丙
二、结晶
1. 定义:从溶液中析出晶体的过程,称为结晶
2. 结晶方法:
(1)蒸发结晶:适用于溶解度随温度变化不大的物质,例如氯化钠

(2)冷却热饱和溶液(也称为降温结晶):适用于溶解度随温度变化大的物质,例如硝酸钾
(3)不饱和溶液---蒸发---饱和溶液---冷却---过滤---得到固体

(4)提纯方法
硝酸钾中有杂质氯化钠,提纯硝酸钾的方法是冷却热饱和溶液
氯化钠中有杂质硝酸钾,提纯氯化钠的方法是蒸发结晶
,