Ca(OH)2 CO2=CaCO3↓ H2O
(7)注意事项:与CO还原氧化铜的实验操作顺序一样,即先通入CO再加热,实验完毕,停止加热,继续通入CO至试管冷却。
②、实验主要现象:红色粉末变为黑色时,澄清的石灰水变浑浊,尾气点燃产生淡蓝色火焰。
③实验注意事项:先能后点,先撤后停。
(8)尾气处理:因CO有毒,不能随意排放在空气中,处理的原则是将CO燃烧掉转化为无毒的CO2或收集备用。
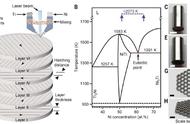
考点11工业炼铁
(1)原理:在高温下,利用焦炭与氧气反应生成的还原剂(CO)将铁从铁矿石里还原出来。
(2)原料:铁矿石、焦炭、石灰石和空气
(3)主要设备:高炉
(4)冶炼过程中发生的化学反应:

注意:石灰石的主要作用是将矿石中的二氧化硅转变为炉渣。
铁的锈蚀
(1)铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3·xH2O)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、电镀、烤蓝等
③制成不锈钢
(3)铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。因而铁锈应及时除去。
(4)铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
注意:
1、铜生铜绿的条件:铜与O 2 、水、CO 2 接触。铜绿的化学式:Cu 2 (OH) 2 CO 3 )。
(1)铁生锈的条件是:铁与O2、水接触。
铁锈的主要成分是氧化铁Fe2O3(红棕色)
(铜生铜绿的条件:铜与O2、水、CO2接触。铜绿的化学式:Cu2(OH)2CO3)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、电镀等
③制成不锈钢
考点16 金属资源的保护和利用
1、金属资源的保护:
①防止金属腐蚀;
②回收利用废旧金属;
③合理开采矿物;
④寻找金属的代用。
2、金属回收再利用的意义:
①防止污染环境;②节约能源;③节约资源。
,