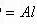一、溶液酸、碱性的判断
(1)表示酸性溶液。
①pH<7或c(H+)>c(OH-)或c(OH-)=10-(8~14) mol·L-1(25 ℃);
②能使pH试纸显红色的溶液;
③能使甲基橙显红色或橙色的溶液;
④能使紫色石蕊溶液显红色的溶液。
(2)表示碱性溶液。
①pH>7或c(H+)<c(OH-)或c(H+)=10-(8~14) mol·L-1(25 ℃);
②能使酚酞溶液显红色的溶液;
③能使紫色石蕊溶液显蓝色的溶液;
④能使pH试纸显蓝色的溶液。
(3)既表示可能为酸性溶液又表示可能为碱性溶液。
①与Al反应放出H2的溶液(注:不能是相当于HNO3形成的酸性溶液);
②由水电离出的c(H+)=1×10-n mol·L-1或由水电离出的c(OH-)=1×10-n mol·L-1的溶液(常温下n≠7)(说明:n<7水解显酸性或碱性,n>7加酸或加碱抑制水的电离);
③与NH4HCO3或(NH4)2CO3等反应放出气体的溶液。
二、离子方程式书写的基本规律
(1)合事实:离子反应要符合客观事实,不可臆造产物及反应。
(2)式正确:化学式与离子符号使用正确合理。
(3)号实际:“===”、“可逆号”、“―→”、“↑”、“↓”等符号符合实际。
(4)三守恒:两边原子数、电荷数必须守恒、氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等。
(5)明类型:依据离子反应原理,分清类型,总结方法技巧。
(6)检查细:结合书写离子方程式过程中易出现的错误,细心检查。
三、判断离子反应顺序的方法
(1)氧化还原型离子反应。
同一氧化剂(或还原剂)可能与多种还原剂(或氧化剂)反应,解此类题应抓住三点:
①确定氧化剂或还原剂强弱顺序。如还原性I->Fe2+>Br->Cl-,氧化性Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+等。
②根据强弱规律,判断反应顺序。同一氧化剂与多种还原剂反应,还原性强的还原剂优先发生反应;同一还原剂与多种氧化剂反应,氧化性强的氧化剂优先发生反应。
③分步计算。先判断过量,后计算。
(2)复分解型离子反应。
判断反应产物与其他成分是否能大量共存。例如,某溶液中含有Al3+、NH、H+,向溶液中逐滴加入氢氧化钠溶液,若先发生反应:NH+OH-=NH3·H2O,则生成的NH3·H2O与H+、Al3+都不能共存,会发生反应:NH3·H2O+H+=NH+H2O,Al3++3NH3·H2O=Al(OH)3↓+3NH。因此,OH-应先与H+反应,再与Al3+反应,最后与NH反应。判断离子反应先后顺序的总规则是先发生反应的反应产物与其他物质能大量共存。
四、离子共存问题的分析
(1)先看条件——题给条件
一看准题干要求,需辨别的离子组是“大量共存”还是“不能大量共存”,是“可能”还是“一定”。
二看准附加条件,如:①溶液的颜色,若为无色溶液则MnO、Fe3+、Cu2+、Fe2+等有色离子不能存在;②溶液的酸、碱性;③特定离子或分子的存在等。
(2)后看反应——所给离子之间能否发生反应
常见发生离子反应不能大量共存的几种情况
反应类型 | 不能大量共存的离子 | |
复分 解反应 | 生成沉淀 | 如Ba2+与CO、SO、SO;SiO与H+不能大量共存 |
生成气体 | H+与CO、HCO、S2-、SO等不能大量共存 | |
生成弱电解质 | H+与OH-、ClO-、F-、CH3COO-不能大量共存 | |
氧化还原反应 | Fe3+能氧化S2-、I-等;MnO、ClO-在酸性、碱性、中性条件下都有强氧化性,能将I-、Fe2+、SO等氧化 | |
盐的双水解 | Al3+与AlO、HCO、CO、S2-、HS-等水解彻底,Fe3+与AlO、HCO、CO等水解彻底,不能大量共存 | |
络合反应 | Fe3+与SCN-;Ag+与NH3·H2O | |
(3)熟记常考离子的性质
颜色 | MnO(紫)、Cu2+(蓝)、Fe2+(浅绿)、Fe3+(黄) |
氧化性 | ClO-、MnO、NO(H+)、Fe3+、Cr2O |
还原性 | S2-(HS-)、SO(HSO)、I-、Br-、Cl-、Fe2+ |
水解显酸性 | NH、Mg2+、Al3+、Cu2+、Fe2+、Fe3+ |
水解显碱性 | AlO、S2-、SO、CO、SiO、ClO-、CH3COO- |
两性离子 | HCO、HS-、HSO、HPO、H2PO |
注意:“两性离子”指既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
五、离子推断
(1)肯定性原则:根据实验现象推出溶液中肯定存在或肯定不存在的离子(记住几种常见的有色离子:Fe2+、Fe3+、Cu2+、MnO、CrO、Cr2O)。
(2)互斥性原则:在肯定某些离子的同时,结合离子共存规律,否定一些离子的存在(要注意题目中的隐含条件,如:酸性、碱性、指示剂的变化、与铝反应产生H2、水的电离情况等)。
(3)电中性原则:溶液呈电中性,一定既有阳离子,又有阴离子,且溶液中正电荷总数与负电荷总数相等(这一原则可帮助我们确定一些隐含的离子)。
(4)进出性原则:通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
六、理解“三大守恒”, 比较离子浓度大小
(1)电荷守恒规律:电解质溶液中,不论存在多少种离子,溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数,如NaHCO3溶液中存在着Na+、H+、HCO、CO、OH-,必存在如下关系:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO)。
(2)物料守恒规律:电解质溶液中,由于某些离子能够水解,离子种类增多,但原子总数是守恒的,如K2S溶液中S2-、HS-都能水解,故硫元素以S2-、HS-、H2S三种形式存在,它们之间有如下守恒关系:c(K+)=2c(S2-)+2c(HS-)+2c(H2S)。
(3)质子守恒规律:质子守恒是指电解质溶液中粒子电离出的氢离子(H+)数等于粒子接受的氢离子(H+)数加游离的氢离子(H+)数。如Na2S水溶液中的质子转移可用图表示如下:

由上图可得Na2S水溶液中质子守恒式可表示为:c(H3O+)+2c(H2S)+c(HS-)=c(OH-)或c(H+)+2c(H2S)+c(HS-)=c(OH-)。质子守恒的关系式也可以由电荷守恒与物料守恒推导得到。
七、沉淀溶解平衡
应用 | 举例 |
沉淀的 生成 | ①调节pH:如CuCl2溶液中含杂质FeCl3,可调节pH至4左右,使Fe3+转化为Fe(OH)3沉淀而除去 ②加沉淀剂法:如以Na2S、H2S等作沉淀剂,使某些金属离子如Cu2+、Hg2+等生成极难溶的硫化物CuS、HgS,是分离、除去杂质常用的方法 |
沉淀的 溶解 | 如用盐酸可溶解碳酸钙沉淀,用NaOH可溶解氢氧化铝沉淀 |
沉淀的 转化 | ①由难溶的沉淀转化为更难溶的沉淀是比较容易实现的一种转化,如在AgCl悬浊液中,加入KI溶液后,沉淀变黄,再加入Na2S溶液,沉淀变黑 ②由难溶的沉淀转化为更易溶的沉淀是比较难以实现的一种转化,转化的前提是“两种沉淀的溶解度相差不是很大”。如虽然Ksp(BaSO4)<Ksp(BaCO3),但两者相差不大,只要用饱和Na2CO3溶液浸泡,BaSO4就可能转化为BaCO3 |
【温馨提醒】
(1)难溶电解质的Ksp数值越小,并不能表明在水中的溶解能力就越弱。当难溶电解质化学式所表示的组成中阴、阳离子个数比相同时,Ksp越小,则难溶电解质在水中的溶解能力就越弱;如果组成中阴、阳离子个数比不同,Ksp不能用于直接判断溶解能力的强弱。
(2)利用生成沉淀的方法不能全部除去要沉淀的离子,一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全。