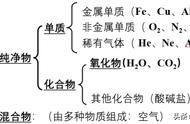
一、化合反应(反应物可以有多个,生成物一定只有一个)
镁在空气中燃烧:
2Mg O2 点燃2MgO
现象:
(1)发出耀眼的白光
(2)放出热量
(3)生成白色粉末
铁在氧气中燃烧:
3Fe 2O2点燃 Fe3O4
现象:
(1)剧烈燃烧,火星四射
(2)放出热量
(3)生成一种黑色固体
注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶 底。
4、铜在空气中受热:
2Cu O2 △ 2CuO
现象:铜丝变黑
5、铝在空气中燃烧:
4Al 3O2 点燃2Al2O3
现象:发出耀眼的白光,放热,有白色固体生成
6、氢气中空气中燃烧:
2H2 O2点燃 2H2O
现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾
7、红(白)磷在空气中燃烧:
4P 5O2 点燃 2P2O5
现象:(1)发出白光(2)放出热量(3)生成大量白烟。
8、硫粉在空气中燃烧:
S O2 点燃 SO2
现象:
A、在纯的氧气中
发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧
(1)发出淡蓝色火焰
(2)放出热量
(3)生成一种有刺激性气味的气体
9、碳在氧气中充分燃烧:
C O2 点燃 CO2
现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊
10、碳在氧气中不充分燃烧:
2C O2 点燃 2CO
11、二氧化碳通过灼热碳层:
C CO2 高温 2CO(是吸热的反应)
12、一氧化碳在氧气中燃烧:
2CO O2 点燃 2CO2
现象:发出蓝色的火焰,放热,澄清石灰水变浑浊
13、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):
CO2 H2O === H2CO3现象:石蕊试液由紫色变成红色。
注意:酸性氧化物+水→酸
如:SO2 H2O === H2SO3SO3 H2O === H2SO4
14、生石灰溶于水:
CaO H2O === Ca(OH)2(此反应放出热量)
注意:碱性氧化物+水→碱
氧化钠溶于水:
Na2O H2O =2NaOH
氧化钾溶于水:
K2O H2O=2KOH
氧化钡溶于水:
BaO H2O==== Ba(OH)2
15、钠在氯气中燃烧:
2Na Cl2点燃 2NaCl
16、无水硫酸铜作干燥剂:
CuSO4 5H2O ==== CuSO4·5H2O
二、分解反应:(反应物有且只能有一个,生成物可以有多个)
17、水在直流电的作用下分解:
2H2O 通电2H2↑ O2 ↑
现象:(1)电极上有气泡产生
H2:O2=2:1
正极产生的气体能使带火星的木条复燃。
负极产生的气体能在空气中燃烧,产生淡蓝色火焰
18、加热碱式碳酸铜:
Cu2(OH)2CO3△2CuO H2O CO2↑
现象:绿色粉末变成黑色,试管内壁有水珠生成,澄清石灰水变浑浊
19、加热氯酸钾(有少量的二氧化锰):
2KClO3 MnO22KCl 3O2 ↑
20、加热高锰酸钾:
2KMnO4 △K2MnO4 MnO2 O2↑
21、实验室用双氧水制氧气:
2H2O2 MnO22H2O O2↑
现象:有气泡产生,带火星的木条复燃
22、加热氧化汞:
2HgO==2Hg O2↑
23、锻烧石灰石:
CaCO3==CaO CO2↑(二氧化碳工业制法)
24、碳酸不稳定而分解:
H2CO3 === H2O CO2↑
现象:石蕊试液由红色变成紫色
25、硫酸铜晶体受热分解:
CuSO4·5H2O 加热 CuSO4 5H2O

三、置换反应:(一种单质和一种化合物反应,生成另一种单质和另一种化合物)注意金属活动顺序表,哪些置换反应可以发生,哪些不能
(1)金属单质 酸 -------- 盐 氢气 (置换反应)
26、锌和稀硫酸反应:
Zn H2SO4=== ZnSO4 H2↑
27、镁和稀硫酸反应:
Mg H2SO4=== MgSO4 H2↑
28、铝和稀硫酸反应:
2Al 3H2SO4=== Al2(SO4)3 3H2↑
29、锌和稀盐酸反应:
Zn 2HCl ===ZnCl2 H2↑
30、镁和稀盐酸反应:
Mg 2HCl ===MgCl2 H2↑
31、铝和稀盐酸反应:
2Al 6HCl === 2AlCl3 3H2↑
26-31的现象:有气泡产生。
32、铁和稀盐酸反应:
Fe 2HCl ===FeCl2 H2↑
33、铁和稀硫酸反应:
Fe H2SO4=== FeSO4 H2↑
32-33的现象:有气泡产生,溶液由无色变成浅绿色。
(2)金属单质 盐(溶液) ---另一种金属 另一种盐
36、铁与硫酸铜反应:
Fe CuSO4==Cu FeSO4
现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色
( 古代湿法制铜及“曾青得铁则化铜”指的是此反应)
40、锌片放入硫酸铜溶液中:
CuSO4 Zn==ZnSO4 Cu
现象:锌片表面覆盖一层红色的物质,溶液由蓝色变成无色。
41、铜片放入硝酸银溶液中:
2AgNO3 Cu==Cu(NO3)2 2Ag
现象:铜片表面覆盖一层银白色的物质,溶液由无色变成蓝色
(3)金属氧化物+木炭或氢气→金属+二氧化碳或水
38、焦炭还原氧化铁:
3C 2Fe2O3 高温4Fe 3CO2↑
39、木炭还原氧化铜:
C 2CuO 高温 2Cu CO2↑
现象:黑色粉未变成红色,澄清石灰水变浑浊
25、氢气还原氧化铜:
H2 CuO △ Cu H2O
现象:黑色粉末变成红色,试管内壁有水珠生成
34、镁和氧化铜反应:
Mg CuO==Cu MgO
35、氢气与氧化铁反应:
Fe2O3 3H2==2Fe 3H2O
37、水蒸气通过灼热碳层:
H2O C 高温H2 CO

四、复分解反应:(两种化合物通过交换成分,生成另外的两种化合物)注:生成物里面必须有气体,沉淀或水中的其中一种,复分解反应才能发生
1、碱性氧化物+酸→盐+H2O
Fe2O3 6HCl==2FeCl3 3H2O
Fe2O3 3H2SO4==Fe2(SO4)3 3H2O
CuO H2SO4==CuSO4 H2O
ZnO 2HNO3==Zn(NO3)3 H2O
2、碱+酸→盐+H2O
Cu(OH)2 2HCl==CuCl2 2H2O
Cu(OH)2 H2SO4==CuSO4 2H2O
NaOH HCl==NaCl H2O
2NaOH H2SO4==Na2SO4 2H2O
NaOH HNO3==NaNO3 H2O
Mg(OH)2 2HNO3==Mg(NO3)2 2H2O
Ba(OH)2 H2SO4==BaSO4↓ 2H2O
3、酸+盐→新盐+新酸
CaCO3 2HCl==CaCl2 H2O CO2↑
Na2CO3 2HCl==2NaCl H2O CO2↑
HCl AgNO3==AgCl↓ HNO3
H2SO4 BaCl2==BaSO4↓ 2HCl
Ba(NO3)2 H2SO4==BaSO4↓ 2HNO3 NaHCO3 HCl==NaCl H2O CO2↑
4、盐1+盐2→新盐1+新盐2
KCl AgNO3==AgCl↓ KNO3
NaCl AgNO3==AgCl↓ NaNO3
Na2SO4 BaCl2==BaSO4↓ 2NaCl
BaCl2 2AgNO3==2AgCl↓ Ba(NO3)2
5、盐+碱→新盐+新碱
CuSO4 2NaOH==Cu(OH)2↓ Na2SO4
FeCl3 3NaOH==Fe(OH)3↓ 3NaCl
Ca(OH)2 Na2CO3==CaCO3↓ 2NaOH
NaOH NH4Cl==NaCl NH3↑ H2O
五、其它反应:
1、二氧化碳通入澄清石灰水:
CO2 Ca(OH)2 ==CaCO3↓ H20
现象:澄清石灰水变浑浊。
(用澄清石灰水可以检验CO2,也可以用CO2检验石灰水)
2、氢氧化钙和二氧化硫反应:
SO2 Ca(OH)2==CaSO3 H20
3、氢氧化钙和三氧化硫反应:
SO3 Ca(OH)2==CaSO4 H20
4、氢氧化钠和二氧化碳反应(除去二氧化碳):
2NaOH CO2==== Na2CO3 H2O
5、氢氧化钠和二氧化硫反应(除去二氧化硫):
2NaOH SO2==== Na2SO3 H2O
6、氢氧化钠和三氧化硫反应(除去三氧化硫):
2NaOH SO3==== Na2SO4 H2O
注意:1-6都是:酸性氧化物 碱 -------- 盐 水
7、甲烷在空气中燃烧:
CH4 2O2点燃 CO2 2H2O
现象:发出明亮的蓝色火焰,烧杯内壁有水珠,澄清石灰水变浑浊
8、酒精在空气中燃烧:
C2H5OH 3O2 点燃 2CO2 3H2O
现象:发出蓝色火焰,烧杯内壁有水珠,澄清石灰水变浑浊
9、一氧化碳还原氧化铜:
CO CuO 加热 Cu CO2
现象:黑色粉未变成红色,澄清石灰水变浑浊
10、一氧化碳还原氧化铁:
3CO Fe2O3高温 2Fe 3CO2
现象:红色粉未变成黑色,澄清石灰水变浑浊。(冶炼铁的主要反应原理)
11、一氧化碳还原氧化亚铁:
FeO CO高温Fe CO2
12、一氧化碳还原四氧化三铁:
Fe3O4 4CO高温3Fe 4CO2
13、光合作用:
6CO2 6H2O光照C6H12O6 6O2
14、葡萄糖的氧化:
C6H12O6 6O2 6CO2 6H2O
,