2. 固体的除杂
(1)固体和杂质均不溶于水
物质状态
依据和方法
举例
两种金属,其中主物质为不活泼金属,杂质为活泼金属
依据:金属活动性顺序
方法:加入足量的稀酸(稀盐酸或稀硫酸),过滤
Cu(Fe)——加入足量的稀硫酸或稀盐酸,过滤
两种金属,其中杂质的金属活动性强于主物质
依据:金属活动性顺序
方法:加入足量的较不活泼金属的盐溶液
Fe(Zn)——加入足量硫酸亚铁溶液,过滤;
Ag(Cu)——加入足量的硝酸银溶液,过滤
金属氧化物中含有其金属单质
依据:金属能与氧气反应
方法:将所含的金属氧化
CuO(Cu)——在空气中(或氧气流中)灼烧混合物
金属氧化物中含有碳单质
依据:碳能在氧气中燃烧
方法:在氧气流中加热,使碳燃烧
CuO(C)——在氧气流中加热
主物质为非金属单质或氢后金属单质,杂质为氢前金属单质
依据:活泼金属能与酸反应
方法:加入足量的稀酸(稀盐酸或稀硫酸),过滤、干燥
C(Fe或Zn)——①加入过量稀酸(稀盐酸或稀硫酸)充分反应、过滤、干燥
②当杂质为铁时,也可以用磁铁吸引
(2)固体(或固体中的杂质)溶于水
①主物质不溶于水、杂质能溶于水
方法:加水溶解、过滤、干燥
如:MnO2(KCl)——溶解、过滤、干燥
CaCO3(CaO或CaCl2)——溶解、过滤、干燥
②主物质溶于水,杂质不溶于水
方法:加水溶解、过滤、蒸发结晶
如:NaCl(泥沙)——溶解、过滤、蒸发结晶
③特殊:CaO(CaCO3)——高温煅烧


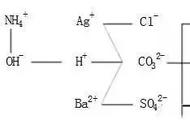
(5)确定除杂试剂:将确定的阴阳离子结合,即HCl、CaCl2、BaCl2,再结合易分离,可以选择的除杂试剂是HCl。
【特别提醒】(1)首先考虑物理方法,再考虑化学方法。
(2)若有多种方法能除去杂质,要选择步骤简单、除杂最彻底的方法。(3)应尽量选择既能除去杂质又能增加主物质的方法。

例下列除去杂质的方法中,合理的是( )
选项
物质
杂质
除杂方法
A
CO
CO2
通入足量的NaOH溶液后,干燥
B
NaCl溶液
NaOH
加入适量稀硫酸
C
铁粉
铜粉
加入足量稀硫酸,过滤
D
CaO
CaCO3
加入适量稀盐酸,过滤