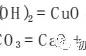化学工艺流程题是高考必考的一道大题,涉及到元素化合物知识的综合应用、化学反应原理、混合物分离提纯的基本方法、化学工艺流程分析、工业生产安全、环保等方方面面的内容。
此题综合性极强,学生失分率很高。为此,今天重点归纳了化学工艺流程题考查的两个工艺、考点分布、主要设问点、重点考查知识、常见的考查方法、对考生的能力要求、考生具备的思维能力、解化学工艺流程题的基本步骤等,希望能对备战高考的师生有所帮助。
1
化学工艺流程题考查的两个工艺。
一是重要物质的制备工艺;二是化学物质回收工艺。此题属于高考新题型,也符合新课改下选拔人才的理念。预计在今后的高考中化学工艺大题仍然会以实际生产为背景,以浓缩型工艺流程图的形式考查学生对基础知识的掌握程度和信息的获取、加工、整合和综合利用的能力。
2
近五年化学工艺流程大题的考点主要分布在三个方面
第一方面是以物质分离、提纯为主线的工艺流程题,约占55%;第二方面是以物质制备为目的的工艺流程题约占34%;第三方面就是以具体物质为载体的无机综合题约占11%。
3
化工大题主要的设问点、重点考查知识、能力要求和思维意识的归纳
提问方式
涉及到知识板块
能力要求
思维意识
陌生方程式的书写
元素化合物性质
离子共存
氧化还原反应
能配化学平方程式或离子反应方程式;
化学反应原理综合分析能力
守恒意识:
原子个数守恒
电子转移守恒
电荷总数守恒
物质分离和提纯方法
元素化合物性质的灵活应用;
分离和提纯混合物的常用方法:过滤、蒸馏、蒸发、结晶、萃取分液等操作的灵活应用
实验能力、元素性质综合应用能力。
科学意识
简便意识
化学工艺条件的选择
化学反应速率、化学平衡的移动
从图中获取信息的能力;
综合应用题干信息解决问题的能力。
效率意识
产率意识
成本意识
平衡常数的计算
沉淀溶解平衡;
弱电解质电离平衡;
浓度平衡常数;
压强平衡常数;
速率常数;
计算能力;
对数据的查阅和分析能力。
平衡意识
速率、产率、转化率或浓度的计算
平衡中三段式计算
计算能力
守恒意识
安全、环保措施
防火灾、防爆炸、防倒吸、防堵塞、防中毒、防污染等方法
接收、吸收、整合信息能力
安全意识
环保意识
电极反应方程式的书写
原电池和电解池工作原理;
电极名称判断等
从题干中获取信息的能力
守恒意识
4
化学工艺流程大题的一般考法归纳
围绕原料的预处理来考查影响化学反应速率的因素;围绕提高原料的利用率或生成物的产率来考查影响化学平衡移动的因素以及催化剂的选择等;围绕经济原则来考查物质的循环利用;围绕产品纯度来考查物质分离、提纯的方法(如蒸馏、蒸发、萃取分液、升华、调节pH值、结晶、过滤、洗涤等);围绕核心反应或副反应来考查陌生化学方程式或离子反应方程式的书写和定量计算;围绕安全环保意识来考查防火、防爆、防倒吸、防堵塞、防污染等具体的措施。
5
强化训练解化学工艺流程题必须具备的五种能力
首先是训练学生对题干信息加工整合能力:能挖掘题干信息,分析原材料,并确定主要成分及所含杂质的能力。其次是要求学生具备原料预处理能力:原材料预处理,通过酸浸和碱浸等手段,完成初步分离的能力。第三学生要具备将化学知识整合和综合应用的能力:学生能分析核心反应,通过氧化、中和以及离子交换等手段完成主要物质到产物的转化的能力。第四要求学生具备实验(混合物分离提纯)能力:能对产品进行的分离和提纯。能通过沉淀、结晶、蒸馏以及煅烧等手段得到产品的能力。第五要求学生具备较强的计算能力:学生能通过滴定等定量过程,完成产品含量测定。并能通过实验数据计算反应物的转化率或产品的产率或通过实验数据对产品的含量进行计算的能力。
6
掌握化学工艺流程题中常考的混合物分离提纯的实验操作原理和方法
1.过滤
把不溶性的固体与液体进行分离的操作方法,如除去粗盐水中不容性固体。
2.结晶
把可溶性固体混合物通过溶解度(随温度的升高溶解度变化不同)的不同而将物质进行分离提纯的方法,如用结晶的方法分离硝酸钾和氯化钠两种物质。另外,提纯苯甲酸时,需要将苯甲酸的粗产品先用热水溶解、蒸发浓缩、趁热过滤除去难溶性杂质,后冷却结晶再过滤、洗涤和干燥得到较纯的苯甲酸晶体。从溶液中得到带结晶水的晶体的规范描述为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
3.蒸馏(分馏)
用于分离沸点差较大的液体混合物,如石油的分馏等。如果物质的沸点很高,一般要采用减压蒸馏。
4.萃取分液
利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来。如用CCl4从碘水中萃取碘,然后用分液法分离出下层的CCl4(含碘)层,上层的水层则从上口倒出。另外,人们习惯用开水泡茶喝,实际上也是萃取过程,只是该过程是固液萃取过程。
5.升华
用于分离固体混合物中某种易升华的组分。如提纯粗碘时利用碘升华的性质,可以用加热粗碘固体,使碘升华而提纯。
7
熟记常考化学工艺术语
关键词
释义
研磨、雾化
将块状或颗粒状的物质磨成粉末或将液体雾化,增大反应物接触面积,以加快反应速率或使反应更充分
灼烧(煅烧)
使固体在高温下分解或改变结构、使杂质高温氧化、分解等。如煅烧石灰石、高岭土、硫铁矿等
浸取
向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸取、酸溶、碱溶、醇溶等
酸浸
在酸性溶液中使可溶性金属离子进入溶液,不溶物通过过滤除去的过程
蒸发结晶
蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会以晶体的形式析出
蒸发浓缩
蒸发除去部分溶剂,提高溶液的浓度
水洗
用水洗除去可溶性杂质,类似的还有酸洗、碱洗、冰水混合物洗、醇水混合物洗、醇洗等
8
了解化学工艺流程题的常见操作与目的
常见的操作
目的
表面处理
用水洗除去表面可溶性杂质,金属晶体可用机械法(打磨)或化学法除去表面氧化物、提高光洁度等
加氧化剂
氧化某物质,生成目标产物或除去某些离子
分离、提纯
过滤、蒸发、萃取、分液、蒸馏等常规操作
从溶液中得到晶体的方法:蒸发浓缩→冷却结晶→过滤→洗涤、干燥
提高原子利用率
绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用)
在空气中或在其他气体中进行的反应或操作
要考虑O2、H2O、CO2或其他气体是否参与反应;或能否达到隔绝空气、防氧化、防水解、防潮解等目的
控制溶液的pH
①调节溶液的酸碱性,使金属离子形成氢氧化物沉淀析出(或抑制水解)
②“酸作用”还可除去氧化物(膜)
③“碱作用”还可除去油污,除去铝片氧化膜,溶解铝、二氧化硅等
④特定的氧化还原反应需要的酸性条件(或碱性条件)
控制温度(常用水浴、冰浴或油浴)
①防止副反应的发生
②使化学平衡移动;控制化学反应的方向
③控制固体的溶解与结晶
④控制反应速率;使催化剂达到最大活性
⑤升温:促进溶液中的气体逸出,使某物质达到沸点挥发
⑥加热煮沸:促进水解,聚沉后利于过滤分离
⑦趁热过滤:减少因降温而析出的溶质的量
⑧降温:防止物质高温分解或挥发;降温(或减压)可以减少能源成本,降低对设备的要求
洗涤晶体
①水洗:通常是为了除去晶体表面水溶性的杂质
②冰水洗涤:能洗去晶体表面的杂质离子,且防止晶体在洗涤过程中的溶解损耗
③用特定有机试剂清洗晶体:洗去晶体表面的杂质,降低晶体的溶解度、有利于析出,减少损耗等
④洗涤沉淀的方法:往漏斗中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次
9
掌握化学工艺流程题的解题步骤
第一步找目的
从题干信息中找到该化学工艺流程题要达到的目的。因为化工题中几乎所有的设问都围绕着又快、又多的实现该化学工艺目的而设置的。弄清楚化学工艺流程题要达到的目的,对后面问题的解决起着十分重要的作用,保证后面在回答问题时不答偏方向,即为解题奠定方向基础。
第二步审问题
看清楚问题的具体指向,不要审错问题。尤其是要看清楚问题要求答什么,以何种方式作答等,千万别犯低级错误而导致丢分。例如题干要求写离子反应方程式,就不能写成化学反应方程式。
第三步审流程
一般化工流程题的流程图都较为复杂。但是问题一般只会涉及到几个关键的步骤,不会全部涉及到,或者有些设问与流程图根本没关系。所以我们不建议学生一开始就去审流程图,一般是要求学生带着问题去研读相应流程图中的某个步骤或图像中回答问题必须要涉及到的具体点。这样可以少走弯路、节省时间,考生可以在极短的时间内快速作答,提高解题的针对性和时效性。确保在150分钟内能将理科综合高质量的完成。
第四步简作答
要求考生细心、准确、规范作答。回答问题时尽可能精简自己的语言,用简洁的文字语言或化学语言(化学反应方程式或离子反应方程式)规范作答。如果语言不简洁,答案冗长、一方面文字不简洁,书写过多浪费自己答题时间,导致理科综合的题做不完;另一方面卷面看起来不整洁影响得分;第三方面影响老师阅卷,阅卷老师要在冗长的文字中去找答案,难免有时候漏看答案,导致考生得分偏低。