在高中化学中碱也是一类常见的物质。那么关于碱类有哪些需要同学们熟悉的知识呢?我认为有以下七个方面。
一、碱的定义:碱是指在水溶液中电离产生的阴离子全部是氢氧根离子的化合物。
二、碱的分类:
1、依碱在水中溶解度的大小,分为:
(1)可溶性碱:常见的有碱金属元素对应的碱、氢氧化钡、一水合氨等。氢氧化钙是微溶性碱。
(2)难溶性碱:如氢氧化镁、氢氧化铁等。
2、依碱完全电离时产生氢氧根离子的多少,分为:
(1)一元碱:如氢氧化钠、一水合氨。
(2)二元碱:如氢氧化钡、氢氧化亚铁等。
(3)多元碱:如氢氧化铁为三元碱。
3、依碱在水中能否完全电离,分为(1)强碱:能完全电离的碱,如氢氧化钡、碱金属元素对应的碱、氢氧化钙。即可溶性碱(除一水合氨外)都是强碱。
(2)弱碱:只部分电离的碱,如一水合氨、难溶性碱(氢氧化镁属于中强碱)。
三、碱的化学通性:(4条)
1、使指示剂变色。石蕊变蓝,丁酚酞变红。
2、与酸反应生成盐和水。
3、与酸性氧化物反应生成盐和水。4、与某些盐反应生成新盐和新碱。注意遵循:强碱制弱碱/稳定性碱制不稳定性碱,要求产物中有沉淀/气体/难电离物生成。
四、碱的制法:
1、金属与水反应生成。
2、碱性氧化物和水反应生成。
3、盐与碱反应生成。
但结合实际应掌握:
(1)氢氧化钠:实验室制法碳酸钠和石灰水反应。工业上电解饱和食盐水。
(2)氢氧化钙:生石灰和水反应。(3)氢氧化铝:实验室用可溶性铝盐与足量氨水反应。
(4)氢氧化镁:可溶性镁盐与可溶性碱反应。
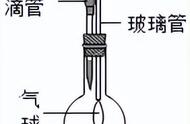
(5)氢氧化亚铁:新制的亚铁盐溶液在无氧环境(加油隔氧或通气氮气、氢气、二氧化碳排氧后)与煮沸过的氢氧化钠溶液(无氧分子)反应,且用长胶头滴管,先伸后挤。目的就是防止氢氧化亚铁被氧化。
(6)氢氧化铁:用可溶性铁盐与可溶性碱(氨水、氢氧化钠等)反应。
(7)氢氧化铜:用可溶性铜盐与氢氧化钠溶液反应得到。注意:在此反应中不宜用氨水。
(8)一水合氨由氨气溶于水得到氨水,将氨水降温冷却可得到一水合氨。
氨气:工业上由氮气、氢气在催化剂存在、高温高压下合成。
实验室由氯化铵和熟石灰,固固混合加热来制取。
五、其他应该注意的问题:
1、氢氧化钠与少量二氧化碳反应生成碳酸钠和水,与足量二氧化碳反应生成碳酸氢钠。石灰水、氢氧化钡与二氧化碳及二氧化硫反应都类似。
2、石灰水与碳酸氢钠溶液反应,二者物质的量比不同产物不同,化学方程式、离子方程式都不同,但反应现在相同,都有白色沉淀生成(碳酸钙)。
3、氢氧化钠与碳酸氢镁溶液反应,不论二者物质的量比怎样,都有氢氧化镁沉淀生成。因为它的溶解度比碳酸镁更小。
4、氢氧化铁与氢碘酸反应生成碘单质和碘化亚铁及水。
5、氢氧化亚铁与硝酸反应生成硝酸铁、氮氧化物及水。
6、氨水与胆矾溶液反应:先生成蓝色沉淀,后随氨水加入沉淀溶解,变成深蓝色溶液,再加无水乙醇析出深蓝色晶体(一水合硫酸四氨合铜)。(选修第二册)
7、氨水和硝酸银溶液反应:先生成白色或棕黑色沉淀,后随氨水加入沉淀溶解,得无色透明的银氨溶液。显然,若向氨水中滴加硝酸银溶液,直接生成氢氧化二氨合银无色溶液,而无明显变化。所以氨水和硝酸银溶液可以通过互滴而加入区别。(选修第二册)
8、氢氧化铝:它既能与强酸反应生成铝盐和水,又能与强碱反应生成偏铝酸盐和水,所以它是两性氢氧化物。证明它在溶液中既存在碱式电离(三元碱),又存在酸式电离(一元酸)。
9、转化:在氢氧化镁向氢氧化铁转化的实验中,必须注意生成氢氧化镁时所用氢氧化钠绝对不能过量,否则不能说明溶解度氢氧化镁较大(选修第一册)
六、有关碱的计算:
1、明白碱溶液中的氢离子全部来自水的电离。
2、碱要抑制水的电离。
3、碱性溶液不一定是碱溶液。
4、求碱溶液、碱溶液稀释、碱溶液混合、反应后呈碱性的溶液,若求其PH,都是先求氢氧根离子浓度,再求氢离子浓度,最后再求PH。5、碱性溶液无限稀释,也是氢氧根离子浓度比氢离子浓度大,PH略大于7(25摄氏度时)(选修第一册)
七、高考中常涉及的碱:氢氧化钠、氢氧化铝、氢氧化钙(钡)、氢氧化铁及其胶体、氢氧化亚铁及其制法、氨水<氨气溶于水所得溶液,含有一水合氨、氨、铵根离子、氢氧根离子等,为混合物。>(挥发性、不稳定性、氨的还原性)。有时也涉及氢氧化铜及氢氧化镁。
一孔之见,定存不妥之处,希朋友们在评论区提出宝贵的意见和建议。互相学习,共同成长!