编辑
添加图片注释,不超过 140 字(可选)
3.氧化剂的影响溶液中存在氧化剂,促使金属钝化。
4、有机表面活性剂的影响它们在电极表面吸附,改变双电层结构,阻止阳极溶解。
溶液pH值的影响金属在中性溶液中,阳极反应比较容易钝化,因为生成溶解度很小的氢氧化物和难溶盐。
金属在酸性溶液中,阳极反应生成溶解度大的金属离子,难以钝化。某些金属在碱性溶液中,也会产生有一定溶解度的酸根离子因而不易钝化。
金属由钝态转为活化的方式:1、消除引起钝化的因素:阳极极化及氧化剂的存在。2、采取活化措施:通阴极电流,使钝化膜还原,加速钝化金属的活化。加入活化剂使钝化了的金属重新活化
第九章
金属的电沉积过程通过电解的方法,在电解池阴极上,金属离子通过还原反应和电结晶过程在固体表面生成金属层。目的:改变固体材料的表面性能或制取特定成分和性能的金属材料
1、液相传质:溶液中的反应粒子向电极表面迁移。
2、前置转化:金属水化离子水化程度降低或重排,金属络离子配 位数降低。
3、电荷传递:反应离子得电子,还原为吸附态金属原子。
4、电结晶:吸附态金属原子沿电极表面扩散到适当位置(生长点),进入金属晶格生长或与其他新生原子集聚而形成晶核并长大。
上述各步骤中,速度最慢的步骤为电沉积过程的速度控制步骤。
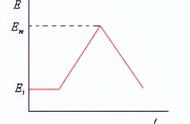
在一定过饱和度的溶液中,能够继续长大的晶核必须具有一定大小的尺寸,即临界晶核尺寸。临界晶核尺寸的大小取决于体系的能量。
如果过电位小,电极过程动力小,由螺旋位错生长方式进行电结晶过程。如果过电位大,电极过程动大,电结晶以形核方式进行。
第十章
1、电池:将化学变化、物理变化释放的能量转为电能的装置。2、化学电源(化学电池):化学能,电能3、化学电源中的活性物质:电池中发生氧化还原反应放出能量的物质。分正极活性物质、负极活性物质。4、一次电源(原电池):活性物质只能使用一次的电池。5、二次电源(蓄电池):放电后经充电可继续使用的电源。6、燃料电池:活性物质由外部连续不断地供给电极的电池。7、物理电池:太阳能电池、原子能电池
提高电动势的方法:正极活性物质使用电子亲合力大、容易还原的物质。负极活性物质使用电子亲合力小、容易氧化的物质。每个电池的电动势往往不一定完全一样,取具有代表性的数值规定为某种电池的电动势,称为额定电压。自放电:化学电源在不向外输出电流时消耗活性物质的现象。原因:活性物质中的杂质与电解质中的杂质在电池内部形成局部电池,造成电池内部短路促进腐蚀,引起自放电。一次电池:将化学能转化为电能并输出的电化学装置。且一旦化学能转变为电能就不能再将电能转变为化学能。按电解液的保持及供给方式分类:干电池湿电池注液电池