大家对有机化学很熟悉
那么我相信题型大家也都知道
那么就准备一些例题供大家参考

1. 0.2mol有机物和0.4mol O2在密闭容器中燃烧后的产物为CO2 CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻了3.2g;最后气体再通过碱石灰被完全吸收,碱石灰的质量增加17.5g。
(1)判断该有机物的化学式
(2)若0.2mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式
(3)若0.2mol该有机物恰好与4.6g金属钠完全反应,试确定该有机物的结构简式
【分析】n(H2O)=10.8/18=0.6 (mol)
n(CO)=3.2/16=0.2 (mol)
n(CO2)=17.6/44-0.2=0.2 (mol)
N(C)=(0.2 0.2)/0.2=2
N(H)=0.6×2/0.2=6
N(O)=(0.6 0.2 0.2×2-0.4×2)/0.2=2
所以分子式:C2H6O2
(2)由上式可知:不饱和度=0,不可能出现不饱和键和官能团。
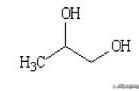
1mol该化合物与2molNa反应,证明其中有两个羟基,故为乙二醇。
HO-CH2CH2-OH
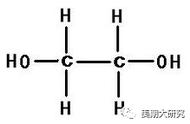
1mol该化合物和1molNa反应,证明其中有一个羟基和一个醚键。
CH3-O-CH2OH
这种题型,不要上来就做,应该分析题意。产物经过硫酸,什么被吸收了?(水,10.8g.,0.6mol,其中含有的氢原子物质的量为1.2mol,所以有机物分子中含有的氢原子个数为6)。然后再通过灼烧的氧化铜,固体质量减轻了3.2g,为什么会减轻,是因为一氧化碳将它还原带走了其中的氧元素(3.2g,0.2mol,所以生成的二氧化碳的量为0.2mol,即有机物燃烧后生成的一氧化碳的量为0.2mol)。最后气体通入碱石灰中,碱石灰增重17.5g,是因为碱石灰吸收了二氧化碳(17.5g,0.4mol。其中由一氧化碳转化生成的一氧化碳量为0.2mol,由有机物燃烧生成的量为0.2mol),综合分析可知由 0.2mol有机物和0.4mol O2反应生成0.6molH2O,0.2mol CO2,0.2molCO,所以有机物分子的化学式为C2H6O2
(2)0.2mol该有机物恰好与9.2g金属钠完全反应,说明一分子的有机物与两分子的钠反应,应该是乙二醇。HOCH2CH2OH(命名为乙二醇)
(3)若0.2mol该有机物恰好与4.6g金属钠完全反应,说明一分子的有机物与一分子的钠反应,仅含有一个羟基,所以只能是CH3OCH2OH(命名为甲氧基甲醇)
2.取有机物3g,在足量氧气中充分燃烧,讲燃烧后的气体通过足量的浓硫酸,浓硫酸质量增加1.8g,将剩余气体通过足量澄清石灰水,得到10g沉淀。1.求该有机物的最简式
2.取一定量该有机物,加热蒸发,测得该有机物的蒸汽密度是相同条件下氢气的15倍,试推测该有机物的分子式和结构简式
【分析】(1)通过足量的浓硫酸后,浓硫酸的质量增加1.8g, 说明3g该有机物燃烧后生成1.8g水,
即3g该有机物中含0.2molH
将剩余气体通过足量澄清石灰水,得到10g沉淀。
说明生成10g碳酸钙 则3g该有机中含C的物质的量为:10/100=0.1mol 0.2mol
H是0.2g,0.1molC是1.2g
由质量守恒可知,3g该有机物中含O的质量为:3-0.2-1.2=1.6(g)
O的物质的量为:1.6/32=0.05(mol)
C:H:O=0.1:0.2:0.05=2:4:1
故该有机物的最简式为C2H4O
(2)该有机物的蒸汽密度是相同条件下氢气的15倍,
则该有机物的摩尔质量为:15×2=30(g/mol)
2n×12+4n×1+n×16=30
n=
【分析】 由3升二氧化碳和3.7升水蒸气可得气体平均分子式为 C3H7.4
假如为丙烯和丙烷,
则碳原子全为3, 氢原子为6和8,
十字交叉, (7.4-6)=1.4,(8-7.4)=0.6,
所以丙烯:丙烷=0.6:1.4=3:7。
同样,可以是丙炔和丙烷,3:17。
如果碳不全为三,则无论如何混合,不能保证碳和氢的平均分别为3和7.4。
4.常温下,一种气体烷烃A和一种气态烯烃B组成的混合气体,已知B分子中所含C原子数大于A分子中所含C原子数。(1)将2L此混合气体充分燃烧,在相同条件下得到7L水蒸气,试推断A、B所有可能的组成及体积比。
(2)取2L混合气体与9.5L氧气恰好完全燃烧,通过计算确定A、B的分子式。
【分析】 (1)设混合气体的平均化学式为CxHy,依题意可知y=7,
则A、B中的氢原子个数介于7的两边,
再依题意B中的碳数大于A的,且都为气体,碳数少于等于4,
所以如果B的H大于7则为C4H8,A为CH4 /C2H6
比值分别是C4H8:CH4=3:1,
C4H8:C2H6=1:1,
如果B的H小于7 则为C2H4、C3H6, A为C3H8/C4H10,
但是由于B的碳数小于A的,排除。
(2)

对于A而言y=2x 2
则有2x y/2=3x 1<9.5或>9.5
分别得出x<3或>3
依题中要求B的C多于A的且均为气体,所以只能2x y/2=3x 1<9.5,
或x<3,
可选CH4 C2H6,此时对于B只能选择C4H8,
因为只有2LC4H8完全燃烧需要的氧气>9.5,
故A为CH4或 C2H6,B为C4H8。
有机化学是化学学科的一个重要分支,它涉及到我们日常生活中的方方面面,对发展国民经济和提高人民生活水平具有重要意义,于是学好有机化学就显得非常重要,很有必要熟练掌握有机化学计算的常用解题技巧。 现把它们归纳如下:
一、比例法
利用燃烧产物CO2和H2O的体积比(相同状况下)可确定碳、氢最简整数比;利用有机物蒸气、CO2和水蒸气体积比(相同状况下)可确定一个分子中含碳、氢原子的个数。若有机物为烃,利用前者只能写出最简式,利用后者可写出分子式
二、差量法
解题时由反应方程式求出一个差量,由题目已知条件求出另一个差量,然后与方程式中任一项列比例求解,运用此法,解完后应将答案代入检验。