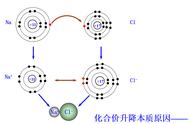
金属阳离子与自由电子间的相互作用
构成元素
典型金属(含NH4 )和典型非金属、含氧酸根
非金属
金属
实例
离子化合物,如典型金属氧化物、强碱、大多数盐
多原子非金属单质、气态氢化物、非金属氧化物、酸等
金属
二、共价键
1、定义:原子间通过共用电子对形成的化学键
本质:高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用。
σ键
π键
成键方向
沿轴方向“头碰头”
平行或“肩并肩”
电子云形状
轴对称
镜像对称
牢固程度
键强度大,不易断裂
键强度较小,容易断裂
成键判断
规律
共价单键全是σ键,共价双键中一个是σ键,另一个是π键;共价叁键中一个σ键,另两个为π键
2、共价键的极性
极性键
非极性键
共用电子对偏移程度
偏移
不偏移
构成元素
不同种非金属元素
同种非金属元素
实例
HCl、H2O、CO2、H2SO4
H2、N2、Cl2
例题1:下列说法正确的是( )
A.π键是由两个P电子“头碰头”重叠形成 B.σ键是镜面对称,而π键是轴对称
C.乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D.H2分子中含σ键而Cl2分子中还含π键.
3、共价键参数
键能: 键长: 键角: 例题2:三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是( )
A.PCl3分子中三个共价键的键长,键角都相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键键能,键角均相等
D.PCl3是非极性分子
三、分子间作用力
1、概念:
2、强弱:
3、对物质性质的影响:
4、氢键:(1)氢键不属于化学键,氢键是在 形成,可以表示为: ,形成氢键的连结氢元素的非金属元素必须具备的条件是:① ,② 。
满足这两个条件的元素有 。
(2)氢键对物质的 、 有较大的影响。如熔沸点反常的氢化物有: 、 、 。
(3)氢键的作用强弱决定于 。
(4)氢键有分子间氢键和分子内氢键,举例说明。
例题3:关于氢键,下列说法正确的是( )
A、每一个水分子内含有两个氢键 B、冰、水和水蒸气中都存在氢键
C、分子间形成的氢键使物质的熔点和沸点升高
D、H2O是一种非常稳定的化合物,这是由于氢键所致
四、等电子原理
等电子原理是指原子总数相同,价电子总数相同的分子具有相似的化学键特征,它们的许多性质相近。
例题4:1919年,1angmuir提出等电子原理:原子数相同、最外层电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的共价分子中,互为等电子体的是: 和 ;
和 。
(2)此后,等电子原理又有发展。例如:由短周期元素组成的物质中,与NO2-互为等电子体的分子有: 。
【考题在线】
(2009北京卷10).甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含l8个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是

A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应

B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键

C.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物