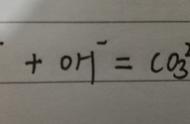1、过氧化钠的结构特点:过氧化钠是离子化合物,阴离子是过氧根(O22-),其中氧元素的化合价为-1价,因此过氧化钠既有氧化性又有还原性,而以氧化性为主,是强氧化剂。
2、过氧化钠不是碱性氧化物:碱性氧化物的定义是:当和酸反应只生成盐和水的氧化物。而过氧化钠与酸反应除了生成盐和水以外,还有氧气生成。例如:
2Na2O2 4HCl=4NaCl 2H2O O2↑
3、过氧化钠的氧化性和还原性:过氧化钠中,杨元素的化合价为-1价,当作氧化剂时,氧元素降至-2价;当作还原剂时,氧元素的化合价为0价。
⑴作氧化剂: Na2O2 SO2=Na2SO4
在碱性条件下可以氧化一些中强氧化性物质。
例:Na2O2 MnO2=Na2MnO4
⑵作还原剂:即遇到强氧化剂时,Na2O2被氧化。
⑶歧化反应
a、与水反应

b、与酸反应

c、与CO2反应 2Na2O2 2CO2=2NaCO3 O2↑
这类反应的实质是过氧化钠先与水作用生成过氧化氢,其后过氧化氢再分解产生氧气。
Na2O2 2H2O=2NaOH H2O2
Na2O2 H2SO4=Na2SO4 H2O2
2H2O2=2H2O O2↑
4、过氧化物的漂白作用与氯气漂白作用类似,是不可逆过程,表现了过氧化钠的强氧化性。
5、Na2O与Na2O2的性质比较:
氧化物 | Na2O | Na2O2 |
结构 | 离子化合物,氧元素化合价为-2价 | 离子化合物,氧元素化合价为-1价 |
类别 | 碱性氧化物 | 过氧化物 |
颜色状态 | 白色固体 | 淡黄色固体 |
与水反应 | Na2O 2H2O=2NaOH | 2Na2O2 2H2O=4NaOH O2↑ |
与CO2反应 | Na2O CO2=Na2CO3 | 2Na2O2 2CO2=2Na2CO3 O2↑ |
与酸反应 | Na2O 2HCl=2NaCl H2O | 2Na2O2 4HCl=4NaCl 2H2O O2↑ |
用途 | 制NaOH | 用于潜水航空的制备剂,做漂白剂(漂白织物羽毛等) |