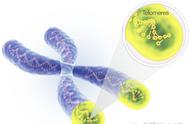
目前很多关于衰老的科学研究都集中在染色体末端的小帽子--端粒(telomeres)上,这些保护性的DNA序列在细胞每次分裂时都会变短一些,但通过干预这个过程,研究人员希望有一天能够调节衰老过程,以及它可能带来的不良健康影响。

现在,来自哈佛大学的一支研究小组在这条科研道路上取得了突破性的进展,他们成功发现了能够恢复小鼠体内端粒长度的小分子。端粒可以被认为是系鞋带时的塑料前端,能够防止基因DNA密码的磨损,在健康衰老过程中发挥着重要作用。但每一次细胞分裂时,它们都会变短一点。这种序列反复重复,直到细胞不能再分裂而死亡。
这个过程与衰老和疾病有关,包括一种罕见的遗传性疾病--先天性角化障碍(DC)。这种疾病是由细胞过早衰老引起的,这也是哈佛大学团队关注的重点,希望能提供替代目前涉及高风险的骨髓移植的治疗方法,而这种治疗方法的收益有限。
先天性角化症的发病方式之一是通过基因突变来实现的,这种基因突变破坏了一种叫做端粒酶的酶,而端粒酶是维持端粒帽结构完整性的关键。为此,几十年来,研究人员一直在研究端粒酶,希望能找到减缓甚至逆转衰老和先天性角化症等疾病的影响。
该科研项目的高级研究者、来自波士顿儿童医院的Suneet Agarwal表示:“自人类端粒酶被确定以来,涌入了大量的生物技术初创公司和大量的投资,但是最终都没有取得成功。市场上也没有相关的药物,公司*了一家又来新的一家。”
Agarwal在过去十年里一直在研究端粒酶的生物学,早在2015年,他和他的团队就发现了一种名为PARN的基因,在端粒酶的作用中起着重要作用。这个基因正常情况下会处理和稳定端粒酶的一个重要成分--TERC,但当它发生变异时,就会导致端粒酶的产生量减少,进而导致端粒过早地变短。
在新的研究中,哈佛大学的研究人员筛选了超过10万种已知的化学物质,寻找能够保护PARN健康功能的化合物。这让他们找到了似乎能够通过抑制一种叫做PAPD5的酶来实现的小部分,这种酶的作用是解开PARN并破坏TERC的稳定。
该论文的第一作者,来自哈佛医学院的Neha Nagpal表示:“我们认为我们针对PAPD5,我们可以保护TERC,恢复端粒酶的正常平衡”。
这些化合物在实验室里用先天性角化障碍患者的细胞制成的干细胞进行了测试。这些化合物提高了这些干细胞中的TERC水平,使端粒恢复到正常长度。然而,该团队真正想测试的是安全性,而不是散射的方法,看看这种疗法是否能精确地针对携带端粒酶形成的正确成分的干细胞。
更具体地说,该团队希望通过让PAPD5抑制药物识别端粒酶的另一个重要成分--一种叫做TERT的分子,并对其做出反应,看看能否实现这一目标。为此,在下一轮实验中,该团队使用了人类血液干细胞,并引发了PARN基因的突变,这些突变导致了先天性角化障碍。
然后将这些细胞植入到接受过化合物治疗的小鼠体内,研究小组发现,这种治疗方法能促进TERC,恢复干细胞的端粒长度,并且对啮齿动物没有任何不良影响。
该团队现在将继续工作,努力证明这些小分子是一种安全有效的方法,可以对先天性角化障碍、其他疾病,以及可能是更广泛的衰老问题起到减缓作用。
Agarwal表示:“我们设想这些将成为一类新的口服药物,针对全身的干细胞。我们预计,恢复干细胞的端粒将增加血液、肺部和其他受DC和其他疾病影响的器官的组织再生能力。”
该研究发表在《Cell Stem Cell.》杂志上。
,