学习目标
1.了解化学反应速率的含义及其表示方法。
2.了解影响化学反应速率的因素。初步了解控制化学反应速率的方法。
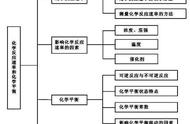
知识点一 化学反应速率
1.表示
化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示。
(1)计算公式:v(A)=Δt(Δc(A))。
(2)常用单位:mol·L-1·s-1或mol·L-1·min-1。
2.意义
化学反应速率是用来衡量化学反应进行快慢程度的物理量,同一化学反应用不同的物质来表示化学反应速率时,其数值可能不同,但这些数值所表示的意义相同。
3.规律
对于同一反应,用不同的物质来表示反应速率,其比值一定等于化学方程式中相应的化学计量数之比。
如对于反应:mA(g)+nB(g)pC(g)+qD(g),v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
知识点二 外界条件对化学反应速率的影响
1.实验探究温度、催化剂对化学反应速率的影响
(1)温度对化学反应速率影响的探究[探究P43]

注意控制变量
(2)催化剂对化学反应速率影响的探究

2.外界条件对化学反应速率的影响

气体的压强改变⇒引起浓度改变⇒速率改变
微判断
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显( )
(2)由v=Δt(Δc)计算平均速率,用反应物表示为正值,用生成物表示为负值( )
(3)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同( )
(4)化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1( )
(5)升温时不论吸热反应还是放热反应,反应速率都增大( )
(6)一定量的锌与过量的稀硫酸反应制取氢气,为减慢反应速率而又不影响生成H2的量,可向其中加入KNO3溶液( )
(7)碳酸钙与盐酸反应的过程中,再增加CaCO3固体,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率( )
1.请从化学反应快慢的角度解释人们为什么使用电冰箱保存食物。
2.工业生产硫酸时,要先将黄铁矿矿石(主要成分为FeS2)粉碎后,再投入沸腾炉,为什么?
3.铁粉与一定浓度的稀盐酸反应时,增加铁粉的用量能否加快化学反应速率?
1.化学反应速率的正确理解
2.化学反应速率的计算方法
(1)根据v(A)=Δt(Δc(A))计算。
(2)根据同一化学反应不同物质的速率之比等于化学方程式中的化学计量数之比计算。
3.反应速率大小比较的两种方法
同一化学反应速率用不同物质表示时数值可能不同,比较化学反应速率的快慢不能只看数值大小,还要进行一定的转化:
(1)换算成同一物质、同一单位表示,再比较数值大小。
(2)比较化学反应速率与化学计量数的比值。如反应aA+bBcC,要比较v(A)与v(B)的相对大小,即比较a(v(A))与b(v(B))的相对大小,若a(v(A))>b(v(B)),则用v(A)表示的反应速率比用v(B)表示的反应速率大。
【例题】 在2 L密闭容器中,发生以下反应:2A(g)+B(g)2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol·L-1·s-1,则10 s时,容器中B的物质的量是( )
A.1.6 mol B.2.8 mol
C.2.4 mol D.1.2 mol
反应:3A(g)+B(g)2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为
①v(A)=0.6 mol·L-1·min-1
②v(B)=0.45 mol·L-1·min-1
③v(C)=0.015 mol·L-1·min-1
④v(D)=0.45 mol·L-1·min-1
则此反应在不同条件下进行最快的是( )
A.②③ B.①③ C.②④ D.②
学习任务2 影响化学反应速率的因素
一、知识要点
化学反应速率影响因素注意点
(1)主要因素(内因)
不同的化学反应,具有不同的反应速率,因此,参加反应的物质的性质是决定化学反应速率的主要因素。
(2)外界因素(外因)
①温度:当其他条件不变时,升高温度,可以增大化学反应速率;降低温度,可以减小化学反应速率。
②催化剂:当其他条件不变时,使用适当的催化剂通常能极大地加快化学反应速率。
③浓度:当其他条件不变时,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率。
④压强:对于有气体参加的反应,当其他条件不变时,增大气体的压强,可以增大化学反应速率;减小气体的压强,可以减小化学反应速率。
⑤固体表面积:固体颗粒越小,其单位质量的表面积越大,与其他反应物的接触面积越大,化学反应速率越大。
⑥反应物状态:一般来说,配成溶液或反应物是气体,都能增大反应物之间的接触面积,有利于增大反应速率。
⑦形成原电池,可以增大氧化还原反应的反应速率。
在密闭容器中发生下列反应:I2(g)+H2(g)2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。

未完,有需要的朋友,私信免费送哦
,