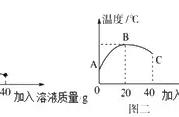
溶质质量分数在考试中与最后一道计算题相联系,是正确解题的前提。
1、溶质的质量分数
(1)定义:溶液中溶液的质量分数是溶质质量与溶液质量之比。
(2)表示方法:溶质的质量分数= 溶质的质量/溶液的质量 ×100%
【注意】①溶质的质量分数和温度无关。
②溶质质量分数单位为1。
③溶质质量分数为10%的含义是指每100份质量的溶液中含溶质质量为10份。
④结晶水合物溶于水,其溶质是不含结晶水的化合物。
⑤发生反应时溶质为新生成的物质。
⑥只有溶解的部分才是溶质。
(3)质量分数变化规律:
①在原溶液中,如增加溶质质量,则溶质和溶液的质量同时增加,溶液中溶质的质量分数升高;
②如增加溶剂质量,则溶剂和溶液的质量同时增加,溶液中溶质的质量分数降低;
③溶液稀释和增浓问题的计算:
★★关键:稀释前 溶质质量 = 稀释后 溶质质量
2.对比掌握溶解度和溶质质量分数
比较项目 | 溶解度 | 溶质质量分数 |
意义 | 表示物质的溶解能力 | 表示溶液中溶质质量的多少 |
温度要求 | 一定 | 不一定 |
溶剂量要求 | 100g | 不一定 |
溶剂状态 | 一定达到饱和 | 不一定达到饱和 |
单位 | 克(g) | 比值(1) |
相 互 关 系 | (1)t℃时,饱和溶液中溶质的质量分数(w)与溶解度(S)换算:w =[S/(100 S)]×100%; (2)任意温度下,溶解度的数值一定大于溶质质量分数的值; (3)一定温度下,物质的溶解度越大,其饱和溶液的溶质质量分数越大; (4)两种物质的溶解度曲线的交点,表示该温度下两物质的溶解度相同,且饱和溶液的溶质质量分数也相同。 | |
3、溶液的配制
配 制 一 定 质 量 分 数 的 溶 液 | 仪器 | 天平、药匙、烧杯、胶头滴管、量筒、玻璃棒 |
步骤 | ① 计算;②称量;③溶解;④装瓶贴标签 | |
误差 分析 | 1、称量物和砝码放反:因实际称取固体质量减少,故配制溶液变稀。 2、量取液体是俯视或仰视 因为俯视读量筒的数值时,读的数值偏大,因此实际量取的体积少了,故配制的溶液变浓; 若仰视读量筒的数值时,读的数值偏小,因此实际量取的体积多了,故配制的溶液变稀。 3、将溶质和溶液倒入烧杯中时 溶质洒落,质量分数偏小; 溶剂洒落,质量分数偏大。 |