电解 electrolysis

将直流电通过电解质溶液或熔体,在电极界面上引起电化学反应的过程。电解在电解池(槽)中进行。电解反应为原电池反应的逆反应。电解过程中电能转变为化学能,在金属冶炼、氯碱工业、无机盐生产、有机化学工业、电镀和电抛光等领域得到广泛应用。
1.简史
1807年H.戴维电解熔融苛性碱制取钾、钠,为获得高纯度物质开拓了新的领域。
19世纪30年代M.法拉第提出电解定律。
1886年C.M.霍尔电解制铝成功。
1890年第一个电解氯化钾制取氯气工厂投产。1893年开始使用隔膜电解法电解食盐水制烧碱。1897年水银电解法制烧碱实现工业化。至此,电解法成为化学工业和冶金工业中的重要生产方法。
2.原理
电解质溶液或熔体中的离子通常处于无规则运动状态。当通直流电后,离子便在电场作用下定向移动,称离子的电迁移。与此同时,在两个电极界面上发生电化学反应,称电极反应。阳离子向阴极方向迁移,在阴极上得电子被还原;阴离子向阳极方向迁移,在阳极上失电子被氧化。

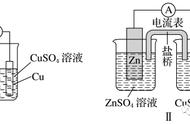
例如,电解氯化铜水溶液时(见图),铜离子向阴极方向迁移,阴极反应为:
(1)
氯离子向阳极方向迁移,阳极反应为:
(2)
阴极反应和阳极反应之和即为电解反应:
所以,在电解氯化铜溶液时,在阴极上沉积出金属铜,在阳极上产生氯气。电解过程中,任何电极上产生的物质的量均遵守法拉第电解定律。
即使电解同一种电解质,如果电极材料不同,或在不同温度和电极电势下进行电解,则电极反应的速率甚至电解产物都可能不同。
电解时,在电极及析出的物质与电解质之间形成电池。电池电动势在数值上等于电解质的理论电解电压,可以由能斯持公式计算。由于电极极化和电解槽存在内阻比实际的电解电压E(也称电压)大于理论电解电压,即
式中和分别为阴极和阳极的超电势,为电解槽的内阻所消耗的电压降。可通过电极材料的选择和表面处理以及改进电解槽的结构,来降低超电势和整个电解槽的电阻,使电解电压尽量减小。
电解槽中的任意离子与它的放电产物构成一个电极,该电极的电势称为这种离子的析出电势。在阴极,析出电势较高的离子优先进行电极反应;在阳极,析出电势较低的离子优先进行电极反应。
电解是一种强有力的氧化还原手段。许多在一般情况下很难发生的氧化还原反应,可以通过电解来实现。例如,只有用电解的方法,才能将熔融的氟化物在阳极上氧化成单质氟。电解熔融的锂盐时,可在阴极上将很难还原的锂离子还原成金属锂。
3.类型
根据电解质的不同状态,通常情况下的电解可分为水溶液电解和熔盐电解两类。根据电极上发生的过程,可分简单电子传递、气体释放、金属腐蚀、金属析出、氧化物生成和有机物电解等类型。
3.1.水溶液电解
以电解食盐水为基础的氯碱工业、冶金工业中的电解精炼和金属电镀、电抛光都属于此类电解。
电解精炼将粗金属作为电解槽的阳极,氧化后变成离子进入溶液,然后在阴极上沉积出品位较高的金属,达到精炼的目的。在电镀过程中,为了改善阴极上析出金属的表面状态,必须在电解液中加入一种或几种添加剂(如动物胶、硫脲和干酪等)。
电抛光是对金属表面进行精加工的一种方法,以悬挂在电解槽中的金属制品作阳极,于特定条件下电解,通过阳极金属的溶解,以消除制品表面的细微不平,使之具有镜面般光泽外观。
为了解决环境污染,也常用电解法除去污水中的某些有害金属离子。
3.2.熔盐电解
主要应用于铝、镁等轻金属和稀有金属的生产。在电解中使用的熔盐电解质应该具有较低的熔点,适当的黏度、密度、表面张力,足够高的电导率,以及相当低的挥发性和不溶解被电解出来的金属熔体等性质。
在大多数情况下,熔盐电解的电流效率低于水溶液电解。影响电流效率的因素有温度、电流密度、极间距离和电解质的性质。其中电解质对金属的溶解是降低电流效率的主要因素。
3.3.有机物电解
电解在有机合成方面具有重要应用。与一般有机合成相比,电有机合成的主要特点是无须向体系中引入额外的氧化剂、还原剂,如在阴极上将葡萄糖还原成山梨醇和甘露醇。这不但可以减少贵重化学药品的消耗,而且还可以消除某些环境污染。电合成可以使某些稳定性差,不宜于在高温高压下进行的反应,得以在常温常压下进行。
此外,在电合成中,通过对电极材料的选择和温度与电压的控制,可以大大降低副反应的反应速率,简化生产中分离与提纯的操作。
摘自:《中国大百科全书(第2版)》第5册,中国大百科全书出版社,2009年