一、电解产物的判断
1. 阳极产物的判断
首先看电极,若是活性电极(一般是除Au、Pt外的金属),则电极材料本身失电子,电极被溶解形成阳离子进入溶液;若是惰性电极(如石墨、铂、金等),则根据溶液中离子放电顺序加以判断。
阳极放电顺序:
金属(一般是除Au、Pt外的金属)>S2->I->Br->Cl->OH->含氧酸根>F-。
⒉ 阴极产物的判断
直接根据溶液中阳离子放电顺序加以判断。
阴极阳离子放电顺序:
Ag >Hg2 >Fe3 >Cu2 >H >Pb2 >Sn2 >Fe2 >Zn2 >H >Al3 >Mg2 >Na >Ca2 >K 。
⒊ 电解后电解质溶液恢复问题
(1) 若阴极为H+放电,则阴极区c(OH-)增大;若阳极为OH-放电,则阳极区c(H+)增大;若阴极、阳极同时有H+、OH-放电,相当于电解水,电解质溶液浓度增大。
(2) 电解过程中产生的H+或OH-,其物质的量等于转移电子的物质的量。
(3) 用惰性电极电解电解质溶液时,若要使电解后的溶液恢复到原状态,应遵循“缺什么加什么,缺多少加多少”的原则,一般加入阴极产物与阳极产物的化合物。
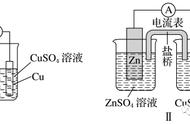
如:用石墨作电极电解CuSO4溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的CuO。
由于石墨为惰性电极,电解CuSO4溶液时,
阳极发生反应:
4OH--4e-=2H2O+O2↑
阴极发生反应:
2Cu2++4e-=2Cu
体系中减少的是氧和铜,要使电解液恢复到起始状态,可向溶液中加入适量的CuO。
⒋ 特别提醒
⑴ 处理有关电解池两极产物的问题,一定要先看电极是活性电极还是惰性电极。活性电极在阳极放电,电极溶解生成相应的金属阳离子,此时阴离子在阳极不放电。对于惰性电极,则只需比较溶液中定向移动到两极的阴、阳离子的放电顺序即可。
⑵ 根据阳离子放电顺序判断阴极产物时,要注意下列三点:
① 阳离子放电顺序表中前一个c(H )与其他离子的浓度相近,后一个c(H )很小,来自水的电离;
② Fe3 得电子能力大于Cu2 ,但第一阶段只能被还原到Fe2
③ Pb2 、Sn2 、Fe2 、Zn2 控制一定条件(即电镀)时也能在水溶液中放电;Al3 、Mg2 、Na 、Ca2 、K 只有在熔融状态下放电。

二 电解方程式的书写
1. 方法步骤
⑴ 首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
① 如果阳极是活泼电极(金属活动顺序表Ag以前),则应是阳极失电子,阳极不断溶解,溶液中的阴离子不能失电子。
② 如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写电极反应式。
阳极(惰性电极)发生氧化反应,阴离子失去电子被氧化的顺序为:
S2->SO32->I->Br->Cl->OH->水电离的OH->含氧酸根离子>F-。
阴极发生还原反应,阳离子得到电子被还原的顺序为:
Ag+>Hg2+>Fe3+>Cu2+>(酸电离出的H+)>Pb2+>Sn2+>Fe2+>Zn2+>(水电离出的H+)>Al3+>Mg2+>Na+>Ca2+>K+。
(注:在水溶液中Al3+、Mg2+、Na+、Ca2+、K+这些活泼金属阳离子不被还原,这些活泼金属的冶炼往往采用电解无水熔融态盐或氧化物而制得)。
⑵ 再分析电解质水溶液的组成,找全离子并分成阴、阳两组,(勿忘水溶液中的H+和OH-)。
⑶ 然后排出阴、阳两极的放电顺序。
⑷ 分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
⑸ 最后写出电解反应的总化学方程式或离子方程式。
⑹ 注意的问题
① 书写电解池中电极反应式时,要以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。
② 要确保两极电子转移数目相同,且注明条件“电解”。
③ 注意题目信息中提示的离子的放电。
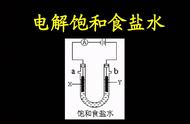
如:书写用石墨作电极,电解饱和食盐水的电极反应式。
由于电极材料为石墨,是惰性电极,不参与电极反应,则书写电极反应式的书写只考虑溶液中的离子放电顺序即可。移向阳极的阴离子有Cl-和水电离出的OH-,但在阳极上放电的是Cl-;移向阴极的阳离子有Na+和水电离出的H+,但在阴极上放电的是H+。所以上述电解池的电极反应为:
阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2↑
或2H2O+2e-=H2↑+2OH-。
若将上述石墨电极改成铜作电极,写电解饱和食盐水的电极反应式。
由于电极材料为Cu,是活泼电极,铜参与阳极反应,溶液中的阴离子不能失电子,但阴极反应仍按溶液中的阳离子放电顺序书写。该电解池的电极反应为:
阳极:Cu-2e-=Cu2+
阴极:2H++2e-=H2↑
或2H2O+2e-=H2↑+2OH-。
(注:阳极产生的Cu2+可与阴极产生的OH-结合成Cu(OH)2沉淀,不会有Cu2+得电子情况发生。

三、电解原理的应用
㈠ 氯碱工业 制烧碱、氯气和氢气
1. 主要生产过程
⑴ 主要步骤:大致可以分为3大步:
① 粗盐的溶解,
② 粗盐水的出杂质(净化),这其中分一次盐水(过滤),二次盐水(精制)。
③ 电解食盐水。
⑵ 电解过程:
向阳极室引入饱和NaCl溶液,阴极室引入蒸馏水,在食盐水里氯化钠完全电离,水分子是微弱电离的,因而存在着Na 、H 、Cl-、OH-四种离子。即:
NaCl=Na Cl-
H2O⇌H OH-(可逆)
在外加直流电场作用下,带负电的OH-和Cl-移向阳极,带正电的Na 和H 移向阴极。
在阳极,Cl-比OH-容易失去电子被氧化成氯原子,氯原子两两结合成氯分子放出氯气。
在阴极,H 比Na 容易得到电子,因而H 不断从阴极获得电子被还原为氢原子,氢原子两两结合成氢分子从阴极放出氢气。
由于阳离子交换膜的固定基团(R-SO3--)带负电荷,它和溶液中的Na 离子异性电荷相吸,结果只允许Na 离子通过,而对Cl-离子排斥,于是Na 离子迁入阴极室,它和OH-相结合,生成NaOH。
H 在阴极上不断得到电子而生成氢气放出,破坏了附近的水的电离平衡,因而水分子大量电离成H 和OH-,且生成OH-的快慢远大于其向阳极定向运动的速率。因此,阴极附近的OH-大量增加,使溶液中产生氢氧化钠:
OH- Na =NaOH
2. 电极反应
阳极:
2Cl--2e-=Cl2↑(氧化反应)
阴极:
2H++2e-=H2↑(还原反应)
总反应:
2NaCl+2H2O=Cl2↑+H2↑+2NaOH