㈡ 电镀:电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法,也用在金属的精炼上。如电镀铜或电解精炼铜(含锌、铁等杂质)时:
如铁件镀锌:
电镀液:含Zn2+的盐溶液(如ZnCl2溶液)
阳极(Zn):Zn-2e-=Zn2+
阴极(铁件):Zn2++2e-=Zn
电镀过程中电镀液浓度不发生变化。镀层金属作阳极,镀件作阴极,电镀液中必须含有镀层金属离子。
㈢ 电冶金属:冶炼钠、钙、镁、铝等活泼金属,必须用电解法。
1. 冶炼钠:
2NaCl(熔融)=(通电)2Na+Cl2↑
电极反应:
阳极:2Cl-—2e-=Cl2↑
阴极:2Na +2e-=2Na
2. 冶炼铝:
2Al2O3(熔融)=(通电 冰晶石)4Al+3O2↑
电极反应:
阳极:6O2-—12e-=3O2↑
阴极:4Al3 +12e-=4Al

3. 冶炼镁:
MgCl2(熔融)=(通电)Mg+Cl2↑
电极反应:
阳极:2Cl-—2e-=Cl2↑
阴极:Mg2 +2e-=Mg
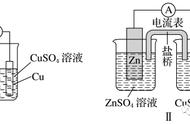
㈣ 电解精炼:如粗铜(含Zn、Fe、Ag等)的提纯
电解质溶液:含Cu2+的盐溶液(如CuSO4溶液)
阳极(粗铜):
Zn-2e-=Zn2+
Fe-2e-=Fe2+
阴极(纯铜):
Cu2++2e-=Cu
电解过程中,活泼性比Cu弱的Ag等不放电,形成阳极泥(可从阳极泥中提纯Ag等);电解质溶液中c(Cu2+)会不断减小,应定期更换电解质溶液。

㈤ 金属的腐蚀与防护
⒈ 化学腐蚀和电化学腐蚀的比较
⑴ 化学腐蚀:金属与接触到的物质直接发生反应,无电流产生;
⑵ 电化学腐蚀:不纯金属接触到电解质溶液发生原电池反应,有微弱电流产生;
⑶ 实质与*
① 实质都是金属原子失去电子被氧化而损耗;
② 化学腐蚀与电化学腐蚀往往同时发生,但电化学腐蚀更普遍、危害性更大、腐蚀速率更快
⒉ 钢铁的析氢腐蚀与吸氧腐蚀
析氢腐蚀:酸性较强
负极反应:Fe-2e-=Fe2+
正极反应:2H++2e-=H2↑
总反应式:Fe2++2OH-=Fe(OH)2
吸氧腐蚀:酸性很弱或呈中性
负极反应:Fe-2e-=Fe2+
正极反应:2H2O+O2+4e-=4OH-
总反应式:2Fe+O2+2H2O=2Fe(OH)2
其他反应及产物:4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3=Fe2O3·xH2O(铁锈)+(3-x)H2O
*吸氧腐蚀更普遍
3. 金属腐蚀规律
金属腐蚀既受到其组成的影响,又受到外界因素的影响。通常金属腐蚀遵循以下规律:
⑴ 在同一电解质溶液中,金属腐蚀的快慢是:
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。
⑵ 在不同溶液中:金属在强电解质溶液中的腐蚀>金属在弱电解质溶液中的腐蚀>金属在非电解质溶液中的腐蚀。
⑶ 对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
⑷ 由于金属表面一般不会遇到酸性较强的溶液,故吸氧腐蚀是金属腐蚀的主要形式,只有在金属活动性顺序表中排在氢以前的金属才可能发生析氢腐蚀,而位于氢之后的金属只能发生吸氧腐蚀。

4. 金属的防护
(1) 电化学保护
① 牺牲阳极的阴极保护法-----原电池原理
负极:比被保护金属活泼的金属;
正极:被保护的金属设备。
② 外加电源的阴极保护法-----电解原理
阴极:被保护的金属设备;
阳极:惰性金属。
(2) 其他方法:
① 改变金属内部结构,如制合金、不锈钢等。
② 外加防护层,如在金属表面涂油、喷漆、搪瓷、电镀、喷镀、烤蓝等。
③ 保持金属制品表面干燥和洁净。