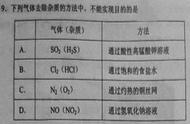
实验原理:
二氧化硫还原性和氧化性,二氧化硫的漂白性。
浓硫酸的强氧化性。
一、二氧化硫的性质
实验一:二氧化硫的还原性
⒈ 实验操作:
用亚硫酸钠与较浓的硫酸反应制备的二氧化硫分别通入酸性KMnO4溶液、溴水中,观察现象。
⒉ 实验现象及结论:
酸性KMnO4溶液和Br2水都褪色。
说明SO2会被强氧化剂KMnO4和Br2氧化,体现了SO2的还原性。
2KMnO4 5SO2 2H2O=K2SO4 2MnSO4 2H2SO4
SO2 Br2 2H2O=2HBr H2SO4
⒊ 问题:将过量SO2通入澄清石灰水中,有何现象?为什么?将SO2通入BaCl2溶液有何现象?为什么?再向其中滴加H2O2溶液或稀硝酸或氯水,有何现象?为什么?写出有关反应的离子方程式。

实验二:二氧化硫的氧化性
⒈ 实验操作:
分别收集一瓶二氧化硫和硫化氢气体,将两瓶气体混合,观察现象。
⒉ 实验现象及结论:
集气瓶内壁有淡黄色固体和水生成。淡黄色固体是硫单质,
说明SO2氧化了H2S生成S和H2O,体现了SO2的氧化性。
SO2 2H2S=3S↓ 2H2O
⒊ 问题:
⑴ 将过量SO2通入Na2S溶液中,有何现象?为什么?写出有关反应的化学方程式。
⑵ 某溶液中混有Na 、S2-、SO32-、SO42-、H 等离子,能否大量共存?为什么?用离子方程式表示。
实验三:二氧化硫的漂白性
⒈ 实验操作:
收集一试管二氧化硫气体,验证其水溶性后在试管的溶液中加入品红溶液,振荡,观察现象;再加热试管,再观察现象。
⒉ 实验现象及结论:
品红溶液红色褪去,加热后红色又恢复。
说明SO2易溶于水且具有漂白性。
⒊ 问题:
⑴ SO2的漂白原理和HClO的漂白原理是否一致呢?为什么?
⑵ 将SO2和Cl2分别通入紫色石蕊试液,有何现象?为什么?
⑶ 如果将SO2和Cl2以体积比通入品红溶液中,有何现象?为什么?
⑷ 请尽可能列举可用来鉴别SO2和CO2气体的方法。

二、浓硫酸的强氧化性
⒈ 实验操作:
将一小片铜片放入盛有浓硫酸的试管中,加热,观察现象。
⒉ 实验现象及结论:
铜片不断溶解,溶液呈蓝色,有刺激性气味气体生成。
说明不活泼的金属铜会被浓硫酸氧化生成硫酸铜,硫酸被还原成SO2,体现了浓硫酸的强氧化性。
Cu 2H2SO4(浓)=CuSO4 SO2↑ 2H2O
⒊ 问题:
在浓硫酸和蔗糖发生反应的实验中,哪些现象是表明浓硫酸的脱水性?哪些现象是表明浓硫酸的强氧化性?写出有关反应的化学方程式。
(变黑是脱水性,因为蔗糖在按照H2O的比例脱水后剩下C,故是黑色的。有刺激性气体生成是SO2,说明浓硫酸被还原了,体现浓硫酸有强氧化性)