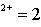任 课 教 师 | 教研室 主任签名 | 教学院长 签名 |
成 绩 统 计 表
题号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 | 八 | 合计 |
得分 | |||||||||
阅卷人 |
考生姓名:____________ 学 号 ___________ 专业班级
注:答案一律写在答提纸上 一、选择题(1×15=15分) 1. 光化学烟雾是一个链反应,链引发反应主要是( ) 2. 属于我国酸雨中关键性离子组分的是( ) 3. 在水体中颗粒物对重金属的吸附量随pH值升高而( ) 4. 有一个垂直湖水,pE随湖的深度增加将( ) 5. 降低pH值,水中沉积物重金属的释放量随之( ) 6. 具有温室效应的气体是( ) A甲烷、H2O C O3、CO B甲烷、SO2 D CO2、SO2 7. 伦敦烟雾事件成为 ,美国洛杉机烟雾成 。 A 光化学烟雾 B 酸性烟雾 C 硫酸性烟雾 D 碱性烟雾 8. 大气逆温现象主要出现在______。 A 寒冷的夜间 B 多云的冬季 C 寒冷而晴朗的冬天 D 寒冷而晴朗的夜间 9. 五十年代日本出现的痛痛病是由______污染水体后引起的。 A Cd B Hg C Pb D As 10 大气中重要自由基是( ) A HO HO2 B HO R C R RO2 D R HO2 11. 在某个单位系的含量比其他体系高得多,则此时该单位体系几乎等于混合复杂体系的PE,称之为“决定电位”。在一般天然水环境中, 是“决定电位”物质。 A 溶解CO2 B 溶解氧 C 溶解SO2 D 溶解NO2 12. 有机污染物一般通过 、 、 、光解和生物富集和生物降解等过程在水体中进行迁移转化。 A 吸附作用 B 配合作用 C 挥发作用 D 水解作用 13. 土壤的可交换性阳离子有两类,一类是致酸离子;另一类是盐基离子,下面离子中属于致酸离子是 。 A H 、Ca2 B H 、Mg2 C Na 、AI3 D H 、AI3 14. 光化学物种吸收光量子后可产生光化学反应的初级过程和次级过程。下面氯化氢的光化学反应过程中属于次级过程的是 。 A HCl hv → H Cl (1) B H HCl → H2 Cl (2) C Cl Cl → M (3) 15. 气块在大气中的稳定度与大气垂直递减率(Г)和干绝热垂直递减率(Гd)两者有关。大气垂直递减率是指 ,若 表明大气是稳定的。 A Г=-dT/dz B Г=dT/dz C Г<Гd D Г>Гd 二、判断题(答在答体纸上,对的打“√” ,错的打“×”,1×15=15分) 1、对于挥发性较小的毒物,可以忽略其挥发作用。 2、一般金属化合物在水中的溶解度大,迁移能力也大。 3、水中的无机氮在较低的pE值时(pE<5)、NO3- 是主要形态。 4、在pH为6的土壤里,铝离子对碱的缓冲能力较大。 5、土壤的活性酸度与潜性酸度是同一个平衡体系的两种酸度。二者可以互相转化。 6、光解作用是有机污染物真正的分解过程 。 8. 自由基具有强还原性,容易去氢夺氧。 9. 大气中重要自由基是HO 、HO2自由基,它们的浓度夏天高于冬天。 10. 控制臭氧浓度,可以缓解光化学烟雾。 11. pE越大,体系夺电子能力低,体系中重金属还原态形式存在。 12. 生物降解有机物存在两种代谢模式,一种是生长代谢,另一种是共代谢。 13. 铝离子对碱缓冲作用,聚合度越大,H 离子越少,对碱缓冲能力低。 14. 重金属在天然水体中主要以腐殖酸配合形式存在。 15. 配体有单齿配体和多齿配体,多齿配合物的稳定性高于单齿配合物。 三、名词解释(2×5=10分) 1. 吸附等温线: 2. 温室效应: 3. 共代谢 4. 标化分配系数 5. 离子交换吸附 四、简答题 (4×5=20分) 1. 大气中的CFCs能破坏臭氧层,写出有关化学反应式。 2. 简述土壤胶体的性质。 3. 试述酸雨的主要成分、成因及写出有关化学反应式。 4. 大气中HO主要来源有哪些?写出相关方程式。 5. 简述水体沉积物中重金属的释放的影响因素 五、计算题(20分) 1. O3的键能为101.2 kJ/mol,,计算可以使O3分子光化学反应裂解成O和O2的最大波长。(光速c = 3.0×108 m/s,普朗克常数h = 6.63×10-34J.s/光量,阿伏加德罗常数N0=6.02×1023)。(7分) 2. 某有机物分子量是为192,溶解在含有悬浮物的水体中,若悬浮物的80%为细颗粒,有机碳含量为10%,其余粗颗粒的有机碳含量为4%,已知该有机物在水中的溶解度为0.08mg/L,求Kp。(8分) 3. 具有3.00×10-3 mol/L碱度的水,pH为8.00,请计算[H2CO3* ]、[HCO3-]、[CO32-]和[OH-]的浓度各是多少?(5分) K1 = 4.45×10-7 ; K2 = 4.69×10-11 六、论述题(2×10=20) 1.结合臭氧层破坏机理,提出保护臭氧层的对策。 2.根据水体重金属迁移转化分析某市一家铅锌冶炼厂的含铅废水经化学处理后排入水体中,排污口水中铅的含量为0.3~0.4mg/L,而在下流500 m处水中铅的含量只有3~4μg/L,试分析其原因? |
《环境化学》A卷标准答案
一、选择题(1×15=15分)
1. C
2. C
3. A
4. A
5. A
6. A
7. CA
8. D
9. A
10. A
11. B
12. ACD
13. D
14. BC
15. AC
二、判断题(1×15=15分)
1.(√) 2.(√) 3.(×)4.(√)5.(√)6(√) 7(√)8(×)
9(√)10(√)11(×)12 (√)13(×) 14 (√)15(√)
三、名词解释(2×5=10分)
1.吸附等温线:在恒温等条件下,(1分) 吸附量Q与吸附物平衡浓度c的关系曲线称为吸附等温线,其相应的数学方程式称为吸附等温式。(1分)
2.温室效应:像 CO2如温室的玻璃一样,它允许来自太阳的可见光射到地,也能阻止地面中的CO2吸收了地面辐射出来的红外光,(1分)把能量截留于大气之中,从而使大气温度升高,这种现象称为温室效应(1分)。
3.共代谢:某些有机污染物不能作为微生物的唯一碳源,(1分)必须有另外的化合物存在提供微生物碳源时,该有机物才能被降解,这种现象称为共代谢。(1分)
4.标化分配系数:有机碳为基础表示的分配系数成为标化分配系数。(1分)用 Ko表示。Koc=Kp/Xox(1分)。
5.离子交换吸附:环境中大部分胶体带负电荷,容易吸附各种阳离子,(1分)在吸附过程中,胶体每吸附一部分阳离子,同时也放出等量的其他阳离子,此吸附称为离子交换吸附(1分)。
四、简答题 (4×5=20分)
1.大气中的CFCs能破坏臭氧层,写出有关化学反应式。
答:F-11(CFCl3)和F-12(CF2Cl2)等氟氯烃。它们在波长175~220nm的紫外光照射下会产生Cl:
(2分)
光解所产生的Cl可破坏O3,其机理为:
总反应
(2分)
2.简述土壤胶体的性质 (4分)
答:1)土壤胶体具有巨大的比表面和表面能(1分)
2) 土壤胶体具有双电层,微粒的内部称微粒核,一一般带负电荷,形成负离子层,其外部由于电性吸引而形成一个正离子层,而形成双电层。(1分)
3)土壤胶体的凝聚性和分散性:由于胶体的比表面和表面能都很大,为减小表面能,胶体具有相互吸引、凝聚的趋势,这就是胶体的凝聚性。但是在土壤溶液中胶体常带负电荷,即具有负的电动电位,所以胶体微粒又因相同电荷而相互排斥,电动电位越高,相互排斥力越强,肢体微粒呈现出的分散性也越强。(2分
3.试述酸雨的主要成分、成因及写出有关化学反应式。
答:酸雨的主要成分是硫酸和硝酸。从污染源排放出来的SO2和NOx经氧化形成硫酸、硝酸和亚硝酸和亚硝酸,这是造成酸雨的主要原因。其形成过程用方程表示如下(1分):
SO2 [O]SO3
SO3 H2OH2SO4
SO3 H2O
H2SO3
H2SO3 [O]
H2SO4
NO [O]
NO2
2NO2 H2O
HNO3 HNO2 (3分)
4. 大气中HO主要来源有哪些?写出相关方程式。
1)O3的光解
对于清洁大气,O3的光解是大气中HO自由基的重要来源:
(2分)
2)HNO2和H2O2的光解
对于污染大气,亚硝酸和H2O2光解是大气中HO重要来源
(2分)
5. 简述水体沉积物中重金属的释放的影响因素
1)盐浓度升高
碱金属或碱土金属能把吸附在固体颗粒上的金属离子释放出来。这是金属从沉积物中释放的主要途径。(1分)
2)氧化还原条件的变化
湖泊、河口及近岸沉积物中含有较多的好氧物质,使一定深度下的氧化还原电位降低,铁、锰等全部或部分溶解,被其吸附的或与之共存的重金属离子也被解析出来。(1分)
3)降低pH值
降低pH值,使碳酸盐和 氢氧化物溶解, H 的竞争增加了金属离子的解析量。(1分)
4)增加水中配合剂的含量
天然或人为的配合剂使用量的增加,可使金属离子形成可溶性配合物,使重金属从固体颗粒上解吸下来。(1分)
四、计算题(20分)
1. O3的键能为101.2 kJ/mol,计算可以使O3分子光化学反应裂解成O和O2的最大波长。(光速c = 3.0×108 m/s,普朗克常数h = 6.63×10-34J.s/光量,阿伏加德罗常数N0=6.02×1023)。(7分)
解:
(2分)
(4分)
=1.183×10-6m
=118.3nm (1分)
答:
使O3分子裂解成O和O2最大波长为118.3 nm。
2. 某有机分子量为192,溶解在含有悬浮物的水体中,若悬浮物中80%为细颗粒,有机碳含量为10%,其余粗颗粒有机碳含量为4%,已知该有机物在水中溶解度为0.08mg/L,求分配系数(Kp)。(8分)
解: ㏒Kow=5.00-0.670㏒(SW
103/M)
㏒Kow=5.00-0.670㏒(0.08
103/192)=5.25
则 Kow=1.78105 (2分)
Koc=0.63Kow=0.631.78105=1.12105 (2分)
(2分)
=1.12
105[0.2(1-0.80)(0.01) 0.85
0.05]
=9.14
103 (2分)
答:该有机物的分配系数Kp是6.63
103。
3. 具有3.00×10-3 mol/L碱度的水,pH为8.00,请计算[H2CO3* ]、[HCO3-]、[CO32-]和[OH-]的浓度各是多少?(5分)
K1 =4.45×10-7 ; K2 = 4.69×10-11
答:根据平衡方程求各种碳酸物百分比确定,当pH=8.00时,CO32-的浓度与HCO3-浓度相比可以忽略,此时碱度全部由HCO3-贡献。
[HCO3-]=[碱度]= 3.00×10-3 mol/L
[OH-]=1.00×10-6 mol/L (2分)
根据离解常数K1,可以计算出的[H2CO3* ]浓度:
[H2CO3* ]=[H][HCO3-]/K1
=1.00×10-6×3.00×10-3/4.45×10-7
=6.75×10-5 mol/L (1.5分)
代入K2的表示式计算[CO32-]:
[CO32-]= K2[HCO3-]/[H ]
=4.69×10-11×3.00×10-3 /1.00×10-6
=1.41×10-5 mol/L (1.5分)
六、论述题(2×10=20)
1.结合臭氧层破坏机理,提出保护臭氧层的对策。
1)破坏机理
水蒸汽、氮氧化物、氟氯烃等能加速臭氧耗损过程,破坏臭氧层的稳定状态,这些物质颗催化臭氧的分解。
a) 氮氧化物的破坏作用
b) HO.自由基对臭氧的破坏作用
c)氟氯烃的破坏作用
d)大气中氧气的过度消耗 (5分)
2)对策与措施
a)采取可行的措施,限制、减少消耗臭氧层人为物质的生产和消费。开展寻找CFCS 和Halon 替代物的研制、生产和相关应用技术的研究。
b)加强废弃CFCS 和Halon 的管理。随着CFCS 和Halon 替代品的应用,废弃CFCS 和Halon 的管理将成为突出的课题,其重要性不亚于CFCS 和Halon 替代品的开发。
c)强化大气化学监测手段,观测大气臭氧层臭氧、氯化物、氮化物传输途径和变化规律,加强臭氧层损耗机理及其对生态环境影响的研究。
d)对超音速飞机加以限制,减少氮氧化物的排放,减少氮肥的使用量和流失量。
e)积极开展保护臭氧层宣传教育工作。进一步引起社会与民众对保护臭氧层的重视,不使用危害臭氧层的物质,同时鼓励推广对环境和人类健康无害的替代物质 (5分)
2.根据水体重金属迁移转化分析某市一家铅锌冶炼厂的含铅废水经化学处理后排入水体中,排污口水中铅的含量为0.3~0.4mg/L,而在下流500 m处水中铅的含量只有3~4μg/L,试分析其原因?
1)含铅废水的稀释、扩散;(1分)
2)水体中胶体物质对重金属的吸附作用 :(2分)
无机胶体:
次生黏土矿物;铁、铝、硅、锰等水合氧化物;
有机胶体:蛋白质、腐殖质。
3)氧化-还原转化:各价态之间的相互转化;(1分)
4)溶解和沉淀反应 :(1分)
5)配合反应 : (2分)
无机配体:OH- Cl- CO32- HCO3- F- S2-
有机配体:氨基酸、糖、腐殖酸
生活废水中的洗涤剂、清洁剂、NTA、EDTA 、农药等
6)生物甲基化作用 .(1分)
7)生物富集作用(2分)