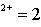第1节 溶液的酸碱性
一、酸性溶液和碱性溶液
1. 酸、碱、盐的定义
(1)酸:电离时阳离子只有H 的物质(H 酸根阴离子)
常见的酸:盐酸,硝酸,硫酸,碳酸---------显酸性
(2)碱:电离时阴离子只有OH—的物质(金属阳离子 OH)
常见的碱:氢氧化钙,氢氧化钠,氢氧化钾,氨水-------显碱性(难溶于水的碱,水溶液不显碱性)
(3)盐:电离时阳离子是金属阳离子或者铵根离子,阴离子是酸根阴离子的物质(金属阳离子/铵根 酸根阴离子)
常见的盐:氯化钙,硫酸钠,氯化钠,氯化铵---显中性、酸性或碱性(碳酸钠、碳酸氢钠、碳酸钾)
二、溶液的酸碱性---指示剂
1. 紫色石蕊试液遇到酸性溶液变 红色,遇到中性溶液不变色还是紫色,遇到碱性溶液变蓝色
2. 无色酚酞试液遇到酸性溶液不变色还是无色,遇到中性溶液不变色还是无色,遇到碱性溶液变红色
3. 红色石蕊试纸遇到碱性溶液变蓝色
4. 蓝色石蕊试纸遇到酸性溶液变红色
5. 溶液使紫色石蕊石蕊变蓝,溶液显碱性,不一定是碱的溶液,也可能是盐的溶液
三、溶液的酸碱度-pH
1. pH值范围:0------7------14
pH<7,溶液显酸性;pH=7,溶液显中性;pH>7,溶液显碱性
pH=1,pH=2,pH=12,pH=13
2. 测pH值方法:
(1)用pH试纸测pH值
①只能测整数
②不能直接插在溶液中测pH值
③不能润湿(测酸性溶液时,pH值偏大,测碱性溶液时,pH值偏小,测中性溶液时,pH值不变)
④步骤:将pH试纸放在表面皿上,用玻璃棒蘸取的试样溶液滴在pH试纸上,待pH试纸变色后,与标准比色卡对照
(2)精确测pH值----pH计也称酸度计
四、溶液酸碱性与生命活动的关系
1.胃酸的成分是盐酸
治疗胃酸过多的药物:氢氧化镁,氢氧化铝,碳酸氢钠
胃溃疡的病人不能用:HCl NaHCO3 = NaCl CO2↑ H2O生成气体,会加重病情
2.改良酸性土壤:熟石灰
3.雨水显酸性的原因, 雨水中溶有空气中的二氧化碳,反应生成碳酸,显酸性
引起酸雨的气体:二氧化硫,二氧化氮,pH<5.6
酸雨中含有的酸:硫酸,硝酸
酸雨的形成的过程:
第一种方法:
S O2 = SO2(条件:点燃)
SO2 H2O = H2SO3
2H2SO3 O2 = 2H2SO4
第二种方法:
S O2 = SO2(条件:点燃)
SO2 O2 = SO3(条件:尘埃)
SO3 H2O = H2SO4