蛋白质作为生命活动的主要执行者,绝大多数疾病的发生都与其结构、功能密切相关。因此,想要对某一特定的蛋白进行分析与研究则成为一项颇为棘手的问题。此时,蛋白标签(Protein tag)开始着手解决这些问题。

蛋白质的检测方法最为应用广泛的是免疫分析,常用的方法有:WB(Western Blot)、ELISA(Enzyme Linked Immunosorbent Assay)、IP(Immunoprecipitation)等。免疫分析需要将目标蛋白作为抗原,注射动物,然后从免疫血清中分离抗体,根据抗原-抗体间的免疫反应进行特异性检测。这种方法最大的缺陷就是每更换一个目标蛋白就要制备一个对应的抗体,操作繁琐,成本昂贵。融合标签的使用,使蛋白质免疫分析走向通用化和便利化。我们将特定的标签与目标蛋白融合后,两者是共同表达的,通过检测融合标签,可以得到目标蛋白的表达情况。

蛋白标签(Protein tag)技术是指利用基因克隆手段,将具有特定功能的多肽,蛋白质结构域,甚至完整蛋白质与目标蛋白融合在一起,以实现目标蛋白的表达纯化,检测和示踪等应用的技术。蛋白标签融合已经成为蛋白质研究中最常用的技术之一。经过长期的研究,目前已经开发出一些比较成熟的检测标签,下面就挑几个来介绍一下:

几种常规蛋白纯化标签比较
常用的蛋白标签有哪些?
HIS标签
His标签是当前最为热门的标签蛋白之一。His6是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对*蛋白进行分离纯化。
Flag-tag
Flag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDDK),同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。
AviTag
是一个15个氨基酸的短肽,具有一个单生物素化赖氨酸位点,与已知天然可生物素化序列完全不同,可以加在目标蛋白的N端和C端。融合表达后,可被生物素连接酶生物素化,为了纯化*蛋白选用低亲和性的单体抗生物素蛋白或抗生物素蛋白衍生物,除了用于蛋白质分离纯化,还用于蛋白质相互作用研究。
SNAP-Tag
SNAP-Tag是从人的O6-甲基鸟嘌呤-DNA甲基转移(O6-alkylguanine-DNA-alkyltransferase)获得。SNAP所带的活性巯基位点接受了苯甲基鸟嘌呤所携带的侧链苯甲基基团,释放出了鸟嘌呤。这种新的硫醚键共价结合使SNAP所带的目的蛋白携带上了苯甲基基团所带的标记物。
检测:生物素或各种颜色荧光的底物(如荧光素、若丹明)可渗透进入细胞,方便快捷地进行活细胞内SNAP-Tag融合蛋白的标记与检测。它们也可特异性地标记大肠杆菌,酵母和哺乳动物等细胞抽提液或已经纯化的蛋白液中的SNAP-tag融合蛋白。
GST(谷胱甘肽巯基转移酶)
GST标签蛋白本身是一个在解毒过程中起到重要作用的转移酶,它的天然大小为26KD。GST融合表达系统广泛应用于各种融合蛋白的表达,可以在大肠杆菌和酵母菌等宿主细胞中表达。结合的融合蛋白在非变性条件下用10mM还原型谷胱甘肽洗脱。GST标签可用酶学分析或免疫分析很方便的检测。标签有助于保护*蛋白免受胞外蛋白酶的降解并提高其稳定性。
纯化:该表达系统表达的GST标签蛋白可直接从细菌裂解液中利用含有还原型谷胱甘肽琼脂糖凝胶亲和树脂进行纯化。
如果要去除GST融合部分,可用位点特异性蛋白酶切除。
GFP
GFP(绿色萤光蛋白)是由下村修等人在水母中发现的。它在蓝色波长范围的光线激发下,会发出绿色萤光。GFP标签可位于蛋白质的C端或N端,该系统已广泛应用于各种细胞类型,包括细菌、酵母和哺乳动物细胞等,相应的GFP标签抗体也被广泛应用。GFP在检测蛋白表达、蛋白和细胞荧光示踪、研究蛋白质之间相互作用和构象变化中,起到了重要的作用。
常规化的c-Myc
C-Myc标签蛋白,是一个含11个氨基酸的小标签,它作为抗原表位表达在不同的蛋白质框架中可识别其相应抗体。C-Myc tag已成功应用在Western-blot杂交技术、免疫沉淀和流式细胞计量术中,可用于检测*蛋白质在靶细胞中的表达。
荧光素酶(luciferase)
来源于生物体内的荧光素,常见的有萤火虫荧光素酶、海肾荧光素酶和Guassia荧光素酶。这些荧光素酶作为“报告蛋白”被用于分子生物学研究中,这种技术被称为报告基因检测法或萤光素酶检测法(Luciferase Assay)。跟普通融合蛋白标签不同,使用荧光素酶构建的报告基因可用作目的基因的定量分析。因此常用于研究启动子、miRNA 3'UTR克隆的功能与调控,因为它们对目的基因的调控可以是渐变的,而不是简单的开和关两种状态。

广泛使用的融合标签的分子量比较
该如何选择表达克隆的标签
1.需要确定融合标签的目的
蛋白纯化 :标签的普遍用途是蛋白纯化。小分子6XHis Tag常被用于细胞内源蛋白的纯化。6XHis Tag也广泛应用于大肠杆菌的蛋白纯化。可是哺乳动物细胞中因非分泌蛋白自身存在高组氨酸背景,因此极少使用6XHis Tag。
Western Blot检测:若需要做Western Blot实验来检测细胞裂解物中蛋白的表达,你可以选择有匹配的抗体的小分子标签。FLAG® Tag以其分子量小以及拥有许多与之匹配的商业化的抗体等优势,成为Western Blot实验中常用的Tag。
免疫沉淀反应:FLAG® Tag其分子量小以及拥有大量相匹配的商业用抗体等优势成为免疫沉淀反应中最常用的Tag. 其他常用的标签有:HA和cMyc.

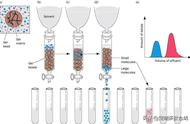
该图显示了免疫共沉淀的步骤。首先,裂解您的样本,以释放蛋白。向试管中添加裂解液的同时,加入靶向融合标签的抗体,抗体会识别融合标签。然后抗体与蛋白 A 或 G 偶联微珠结合,后者拉出您的目标蛋白,以及与之复合的其他蛋白。
活细胞成像:荧光蛋白(Fluorescent Proteins, FPs)是活细胞成像常用的标记蛋白。其中最常用的是绿色荧光蛋白(GFP)和它的衍生物(CFP, YFP, etc.),以及一些红色变体,如dTomato和mCherry.
2.考虑融合标签的影响
任何一类标签处于氨基酸序列的任一位置,都具有影响目的蛋白表达或功能的可能性。最主要原因是标签可能会干扰蛋白的正确折叠,致使目的蛋白失活或形成包涵体。其次,标签可能会中断亚细胞定位信号,这种情况下,蛋白能够正确翻译和折叠,但在细胞内所处的位置是错误的。因此,您需要知道添加的标签对目的蛋白的表达是否有影响。
3.考虑是在N-端还是C-端标记
N-端或C-端标记的选择还需要根据蛋白结构、定位等特性。然而,倘若你没有确切的蛋白结构,或蛋白功能域图谱,建议分别构建N-端标记和C-端标记的表达克隆,以检测哪个更有效。
*蛋白表达技术现已在生物学各个具体领域应用广泛,尤其是蛋白质的大规模生产和体内功能研究都需要应用*蛋白表达载体。