【一分钟导读】:
该研究为一项开放标签、剂量递增、剂量扩展的ⅠB期试验,以评估瑞戈非尼和纳武利尤单抗在晚期胃癌和结直肠癌的应用。
纳入研究的患者参加了剂量确定试验,以估计最大耐受剂量;其余患者参加了剂量扩展试验。瑞戈非尼的剂量为80-160mg qd,连续21天/停药7天,纳武利尤单抗的剂量为3mg/kg q2w。主要终点为前4周的剂量限制性毒性(DLT),以估算推荐剂量。
试验共招募了50例患者(胃癌和肠癌各25例)。所有患者既往接受过≥2种的化疗方案,其中96%的患者接受了抗血管生成抑制剂治疗,7例患者既往行免疫检查点抑制剂治疗。瑞戈非尼160mg组发生3种DLT(3级结肠穿孔、斑丘疹和蛋白尿),在80mg和120mg剂量组均未发生。在剂量递增阶段,由于斑丘疹的频繁发生,瑞戈非尼的剂量从120mg降低至80mg。常见的≥治疗相关不良事件为皮疹(12%)、蛋白尿(12%)和手足综合征(10%)。20例患者表现出客观肿瘤缓解(40%),其中包括11例胃癌(44%)和9例肠癌(36%)。胃癌和肠癌患者的中位无进展生存期分别为5.6和7.9个月。
研究提示,80mg瑞戈非尼联合纳武利尤单抗具有可控的安全性,并且在胃癌和肠癌患者中具有令人鼓舞的抗肿瘤活性,有必要在更大的人群中进一步验证。
标题:Regorafenib Plus Nivolumab in Patients With Advanced Gastric or Colorectal Cancer: An Open-Label, Dose-Escalation, and Dose-Expansion Phase Ib Trial (REGONIVO, EPOC1603)
期刊:J Clin Oncol(28.245). Pub Date: 2020 Apr 28.
作者:Shota Fukuoka 1 2, Hiroki Hara 3, Naoki Takahashi, et al.
地址:DOI: 10.1200/JCO.19.03296
2、弥漫性胃癌对紫杉类耐药可能与微管蛋白稳定性受损有关
【一分钟导读】:
以紫杉类药物为基础的化疗是晚期胃癌(GC)的标准治疗方法,但大多数患者对紫杉类药物具有固有耐药性。该研究旨在确定GC中紫杉类耐药的分子基础。
研究者对TAX-325临床试验进行了析因分析,并对GC细胞系进行了检测,以评估多西他赛在弥漫型胃癌(DIF-GC)和肠型胃癌(INT-GC)中的疗效。分析了GC细胞和从紫杉类治疗后的GC患者活检取得的肿瘤细胞的微管稳定性,并进行了转录组分析,以确定紫杉类耐药的分子驱动因素。
结果表明,INT-GC患者(共239名)从多西他赛联合标准化疗的方案中有显著的生存获益(12.1 vs 8.8个月,p=0.002),DIF-GC患者(共206名)未能从联合多西他赛的治疗中获益(8.3 vs 8.5个月,p=0.66)。联合多西他赛后,INT-GC组有更高的缓解率(45.4% vs 28.2%仅单用CF方案,p0.006),DIF-GC组的总体缓解率并未有显著差异(p=0.263)。DIC-GC患者未能从联合紫杉类治疗中获益,提示其对紫杉类药物具有固有耐药性。DIF-GC细胞系在无微管蛋白突变或药物蓄积减少的情况下,由于药物诱导的微管稳定性受损,表现出对紫杉类特异的固有耐药性。紫杉类治疗的GC患者活检结果证明,紫杉耐药与药物靶向结合作用无关。紫杉类敏感性细胞系在基线时表现出较快的微管动力,提示该细胞骨架蛋白质可能调节紫杉类固有耐药性。对GC细胞和活检标本的基因表达分析确定了紫杉类敏感性相关的驱动蛋白。
研究表明,DIF-GC患者中紫杉类耐药性更为普遍,鼓励对驱动蛋白和微管相关蛋白在GC中紫杉类耐药性的作用进一步研究。
标题:Microtubule Engagement With Taxane Is Altered in Taxane-Resistant Gastric Cancer.
期刊:Clin Cancer Res. (8.911). Pub Date: 2020 Apr 22.
作者:Giuseppe Galletti , Chao Zhang , Ada Gjyrezi , et al.
地址:DOI: 10.1158 / 1078-0432.CCR-19-3018.
3、Bintrafusp Alfa可成为亚洲人群复发难治性胃癌的一种新型治疗方法
【一分钟导读】:
晚期胃/胃食管交界处癌(GC / GEJC)患者在一线治疗失败后的治疗选择有限。Bintrafusp alfa是一种新的双功能融合蛋白,由TGF-βRII受体的胞外域与PD-L1的IgG1抗体融合而成。研究旨在为这些患者提供一种新的治疗方法。
该Ⅰ期临床试验纳入没有标准治疗方案或者标准治疗失败的复发性GC/GEJC亚洲患者,每2周接受1200毫克的Bintrafusp alfa治疗,直至疾病进展、不能耐受的不良反应或退出研究。主要目的是评估安全性/耐受性。
截至2018年7月23日,有31名患者接受了Bintrafusp alfa治疗,中位时间为10.1周,3名患者仍在接受治疗。6名患者(19%)发生了3级治疗相关不良事件(AEs);没有发生4级事件。有1名患者在治疗过程中突然死亡,可疑原因是先前存在的胸主动脉瘤破裂。10名患者(32%)发生免疫相关的不良事件。独立审核委员会评估的客观缓解率(ORR)为16%;疾病控制率为26%。中位缓解时间为8.7个月(2.4-12.4 )。肿瘤缓解与PD-L1表达水平或微卫星不稳定性状态无关,并且似乎与肿瘤TGFB1高水平相关。
研究表明,bintrafusp alfa在晚期GC / GEJC的亚洲人群中表现出可控的安全性和临床活性,需要进一步的研究验证。
标题:Safety and Tolerability of Bintrafusp Alfa, a Bifunctional Fusion Protein Targeting TGF-β and PD-L1, in Asian Patients With Pretreated Recurrent or Refractory Gastric Cancer.
期刊:Clin Cancer Res (8.911). Pub Date: 2020 Apr 16.
作者:Yoon-Koo Kang, Yung-Jue Bang, Shunsuke Kondo, et al.
地址:DOI: 10.1158 / 1078-0432.CCR-19-3806.
4、胃癌晚期二线雷莫芦单抗治疗能否达到肿瘤缓解对三线CPI治疗疗效的影响
【一分钟导读】:
紫杉醇加雷莫芦单抗作为二线治疗,后续再三线使用检查点抑制剂(CPI)已成为晚期胃癌的标准治疗策略。该研究评估了既往使用雷莫芦单抗对三线免疫治疗疗效的影响,并进行了探索性分析,以寻找预测免疫治疗疗效的潜在生物标志物。
研究者对2015年1月至2019年3月间接受CPI作为晚期胃癌三线治疗的患者的临床病理数据进行了回顾性分析,包括患者特征,组织病理学报告以及治疗类型和预后。
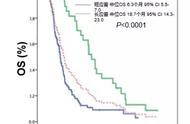
共有74名患者纳入分析,分别有45例(61%)和29例(39%)接受了纳武利尤单抗和帕博利珠单抗作为三线治疗。在既往二线治疗中,有41例(55%)患者接受了雷莫芦单抗加紫杉醇治疗,33例(45%)仅接受单纯化疗,结果表明两组的疾病控制率(DCR)无统计学差异。二线治疗单纯化疗组的总生存期(OS)高于联合治疗组(5.6 vs 4.8个月,HR:0.56,95%[CI]:0.33-0.96;p=0.03),但是在多变量分析中未能得到相同结论。探索性分析表明,既往接受雷莫芦单抗和紫杉醇类药物达到肿瘤缓解的患者与未缓解的患者相比,后续CPI治疗获益更大(中位OS 9.9 vs 2.3个月,HR:0.20,95%[CI]:0.07-0.54;p<0.001)。多变量分析表明,既往雷莫芦单抗和紫杉醇的治疗达到肿瘤缓解是三线CPI治疗OS的独立预后因素。
研究提示,既往雷莫芦单抗和紫杉醇的二线治疗达到肿瘤缓解是三线CPI治疗OS的独立预后因素。这一结论可能为晚期胃癌患者接受三线CPI治疗提供有价值的信息。
标题:Impact of Prior Ramucirumab Use on Treatment Outcomes of Checkpoint Inhibitors in Advanced Gastric Cancer Patients
期刊:Target Oncol(3.683). Pub Date: 2020 Apr.
作者:Jinchul Kim , Seonggyu Byeon , Hyera Kim, et al.
地址:DOI: 10.1007/s11523-020-00713-1
5、≥pT2或pN 的胃癌患者接受D 式和D2式淋巴结清扫术的生存预后比较【一分钟导读】:
D2淋巴结清扫术(LND)是进展期胃癌(AGC)的标准术式,但是几乎没有证据支持D2式优于D1 式。这项研究比较了D2式和D1 式LND对AGC的长期疗效。
研究对1121例行根治性远端胃切除术并且病理分期≥pT2或pN 的患者数据进行了回顾性分析,将患者分为D1 和D2 LND组,比较了两组长期存活率。
结果表明,分别有909例和212例患者接受了D2式和D1 式LND。D2组的病理分期更晚,并且开腹手术率更高,术后并发症的发生率明显更高(19.5%vs 13.2%,p=0.034)。但是两组之间的死亡率或≥III级并发症无显着差异,两组中相同病理分期的患者5年总生存期(OS)和无病生存期(DFS)无显著差异。对预后因素的多变量分析表明,在调整了肿瘤分期和其他临床病理因素后,淋巴结清扫的范围并未显著影响生存。在PSM队列中,D2和D1组的OS(p=0.488)和DFS(p=0.705)无显著差异。
研究提示,对于≥pT2或pN 的胃癌,D1 式LND的长期生存与D2式LND相当。有必要进行大型随机试验,以明确胃癌手术淋巴结清扫的最佳范围。
标题:Comparison of Long Term Survival Outcomes Between D1 and D2 Lymph Node Dissection for ≥ pT2 or pN Gastric Carcinoma: A Large Scale Case-Control Study Using Propensity Score Matching
期刊:Eur J Surg Oncol(3.379). 2020 Apr 14.
作者:Ji Hoon Kang , Seong Yeob Ryu , Mi Ran Jung, et al.
地址:DOI: 10.1016/j.ejso.2020.04.013.
6、阿格列汀可能对预防奥沙利铂引起的周围神经病变有益
【一分钟导读】:
奥沙利铂是一种铂类抗肿瘤药,通常用于治疗肠癌,胃癌和胰腺癌。周围神经病变是奥沙利铂引起的常见剂量限制性毒性不良反应,并且缺乏预防方法。阿格列汀可通过抑制二肽基肽酶4(DPP-4)起到降糖作用。先前的研究表明,DPP-4抑制剂具有多效性,包括神经保护作用。
该研究使用体外和体内模型评估了阿格列汀对奥沙利铂引起的周围神经病变的影响。在PC12细胞中,阿格列汀可减轻由奥沙利铂和顺铂引起的神经突病变。反复注射奥沙利铂可引起大鼠坐骨神经机械性异常性疼痛和轴突变性,而阿格列汀可改善这些神经病变。此外,阿格列汀没有减弱奥沙利铂对结肠癌、胃癌或胰腺癌细胞和荷瘤小鼠肿瘤细胞的毒性。
研究提示,阿格列汀可能对预防奥沙利铂引起的周围神经病变有益,同时不影响抗肿瘤活性。
标题:Neuroprotective Effect of Alogliptin on Oxaliplatin-Induced Peripheral Neuropathy in Vivo and in Vitro.
期刊:Sci Rep(4.011). Pub Date: 2020 Apr 21.
作者:Nao Shigematsu ,Takehiro Kawashiri, Daisuke Kobayashi, et al.
地址:DOI: 10.1038/s41598-020-62738-w.
7、长期使用低剂量阿司匹林可降低胃癌和食管癌的风险
【一分钟导读】:
低剂量阿司匹林对胃肠道肿瘤的潜在保护作用越来越受到人们的关注。研究旨在根据英国的人群基础保健数据库来评估低剂量阿司匹林与胃癌/食管癌风险之间的关系。
在2005年1月至2015年12月之间,研究者从数据库中确定了223640名低剂量阿司匹林(75-300毫克/天)的人群和未使用阿司匹林的人群,通过队列研究确定胃/食道癌的病例。使用逻辑回归方法计算病例组和对照组的校正ORs和95%CIs。对当前使用低剂量阿司匹林的定义为:在索引日期(病例组的患病时间,对照组的随机时间)0-90天前使用低剂量阿司匹林,既往使用时间超过1年。
研究共分析了727例胃癌和1394例食管癌。胃癌的ORs(95%CIs)为0.46(0.38-0.57),食管癌为0.59(0.51-0.69)。既往阿司匹林使用时间1-3年、3-5年或>5年在降低患病风险方面无显著差异。
研究表明,低剂量阿司匹林的使用可减少54%的胃癌风险,降低41%的食道癌风险。
标题:Low-dose Aspirin and Risk of Gastric and Oesophageal Cancer: A Population-Based Study in the United Kingdom Using The Health Improvement Network.
期刊:Int J Cancer(4.982). Pub Date: 2020 Apr 24.
作者:Luis A García Rodríguez , Montse Soriano-Gabarró , Pareen Vora , Lucía Cea Soriano.
地址:DOI: 10.1002/ijc.33022.
,