下面是小编整理的比较重要的数学公式及化学公式,同学们可以在考前再认真的复习一遍,要仔细阅读哦!

一、高中数学必考重点公式总结归纳
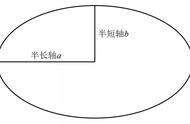
椭圆周长计算公式
椭圆周长公式:L=2πb 4(a-b)
椭圆周长定理:椭圆的周长等于该椭圆短半轴长为半径的圆周长(2πb)加上四倍的该椭圆长半轴长(a)与短半轴长(b)的差。
椭圆面积计算公式
椭圆面积公式: S=πab
椭圆面积定理:椭圆的面积等于圆周率(π)乘该椭圆长半轴长(a)与短半轴长(b)的乘积。
以上椭圆周长、面积公式中虽然没有出现椭圆周率T,但这两个公式都是通过椭圆周率T推导演变而来。常数为体,公式为用。
椭圆形物体 体积计算公式椭圆 的 长半径*短半径*PAI*高
三角函数:
两角和公式
sin(A B)=sinAcosB cosAsinB sin(A-B)=sinAcosB-sinBcosA
cos(A B)=cosAcosB-sinAsinB cos(A-B)=cosAcosB sinAsinB
tan(A B)=(tanA tanB)/(1-tanAtanB) tan(A-B)=(tanA-tanB)/(1 tanAtanB)
cot(A B)=(cotAcotB-1)/(cotB cotA) cot(A-B)=(cotAcotB 1)/(cotB-cotA)
倍角公式
tan2A=2tanA/(1-tan2A) cot2A=(cot2A-1)/2cota
cos2a=cos2a-sin2a=2cos2a-1=1-2sin2a
sinα sin(α 2π/n) sin(α 2π*2/n) sin(α 2π*3/n) …… sin[α 2π*(n-1)/n]=0
cosα cos(α 2π/n) cos(α 2π*2/n) cos(α 2π*3/n) …… cos[α 2π*(n-1)/n]=0 以及
sin^2(α) sin^2(α-2π/3) sin^2(α 2π/3)=3/2
tanAtanBtan(A B) tanA tanB-tan(A B)=0
半角公式
sin(A/2)=√((1-cosA)/2) sin(A/2)=-√((1-cosA)/2)
cos(A/2)=√((1 cosA)/2) cos(A/2)=-√((1 cosA)/2)
tan(A/2)=√((1-cosA)/((1 cosA)) tan(A/2)=-√((1-cosA)/((1 cosA))
cot(A/2)=√((1 cosA)/((1-cosA)) cot(A/2)=-√((1 cosA)/((1-cosA))
和差化积
2sinAcosB=sin(A B) sin(A-B) 2cosAsinB=sin(A B)-sin(A-B)
2cosAcosB=cos(A B)-sin(A-B) -2sinAsinB=cos(A B)-cos(A-B)
sinA sinB=2sin((A B)/2)cos((A-B)/2 cosA cosB=2cos((A B)/2)sin((A-B)/2)
tanA tanB=sin(A B)/cosAcosB tanA-tanB=sin(A-B)/cosAcosB
cotA cotBsin(A B)/sinAsinB -cotA cotBsin(A B)/sinAsinB
某些数列前n项和
1 2 3 4 5 6 7 8 9 … n=n(n 1)/2 1 3 5 7 9 11 13 15 … (2n-1)=n2
2 4 6 8 10 12 14 … (2n)=n(n 1) 1^2 2^2 3^2 4^2 5^2 6^2 7^2 8^2 … n^2=n(n 1)(2n 1)/6
1^3 2^3 3^3 4^3 5^3 6^3 …n^3=(n(n 1)/2)^2 1*2 2*3 3*4 4*5 5*6 6*7 … n(n 1)=n(n 1)(n 2)/3
正弦定理 a/sinA=b/sinB=c/sinC=2R 注: 其中 R 表示三角形的外接圆半径
余弦定理 b2=a2 c2-2accosB 注:角B是边a和边c的夹角
乘法与因式分 a2-b2=(a b)(a-b) a3 b3=(a b)(a2-ab b2) a3-b3=(a-b(a2 ab b2)
三角不等式 |a b|≤|a| |b| |a-b|≤|a| |b| |a|≤b<=>-b≤a≤b
|a-b|≥|a|-|b| -|a|≤a≤|a|
一元二次方程的解 -b √(b2-4ac)/2a -b-√(b2-4ac)/2a
根与系数的关系 x1 x2=-b/a x1*x2=c/a 注:韦达定理
判别式 b2-4a=0 注:方程有相等的两实根
b2-4ac>0 注:方程有两个不相等的个实根
b2-4ac<0 注:方程有共轭复数根
二、高中化学必背公式总结
1.碳与氧气(不足)的反应2C O2==== 2CO碳与氧气(充足)的反应C O2==== CO2
2.一氧化碳与氧气的反应2CO O2==== 2CO2
3.二氧化碳与碳的反应CO2 C==== 2CO
4.碳酸氢钠与盐酸的反应NaHCO3 HCl==== NaCl H2O CO2↑
5.碳酸钠与盐酸的反应Na2CO3 2HCl==== 2NaCl H2O CO2↑
6.碳酸钙与盐酸的反应CaCO3 2HCl==== CaCl2 H2O CO2↑
7.碳酸氢钠与氢氧化钠的反应NaHCO3 NaOH==== Na2CO3 H2O
8.碳酸钠与氢氧化钙的反应Na2CO3 Ca(OH)2==== CaCO3↓ 2NaOH
9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3 Ca(OH)2==== CaCO3↓ NaOH H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3 Ca(OH)2==== CaCO3 Na2CO3 2H2O
10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3 H2O CO2↑
11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓ H2O CO2↑
12.碳酸钙加热的反应CaCO3==== CaO CO2↑
13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2 2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2 CO2==== CaCO3↓ H2O
14.氮气与氧气的反应N2 O2==== 2NO
15.一氧化氮与氧气的反应2NO O2==== 2NO2
16.二氧化氮与水的反应3NO2 H2O==== 2HNO3 NO
17.氮气与氢气的反应N2 3H2========= 2NH3
18.氨气与水的反应NH3 H2O==== NH3?H2O
19.氨气与盐酸的反应NH3 HCl==== NH4Cl
20.氨气与硫酸的反应2NH3 H2SO4==== (NH4)2SO4
21.氨气与强酸的离子的反应NH3 H ==== NH4
22.氨的催化氧化的反应4NH3 5O2====== 4NO 6H2O
23.碳酸氢铵加热的反应NH4HCO3==== NH3↑ CO2↑ H2O
24.氯化铵加热的反应NH4Cl==== NH3↑ HCl↑
25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑ CO2↑ H2O
26.氯化铵与氢氧化钙的反应2NH4Cl Ca(OH)2==== CaCl2 2NH3↑ 2H2O
27.氯化铵与氢氧化钠的反应NH4Cl NaOH==== NaCl NH3↑ H2O
28.碳酸氢铵与氢氧化钠的反应NH4HCO3 2NaOH==== Na2CO3 NH3↑ 2H2O
29.碳酸氢铵与氢氧化钙的反应NH4HCO3 Ca(OH)2==== CaCO3↓ NH3↑ 2H2O
30.硝酸的分解的反应4HNO3========= 4NO2↑ O2↑ 2H2O
31.铜与浓硝酸的反应Cu 4HNO3(浓)==== Cu(NO3)2 2NO2↑ 2H2O
32.铜与稀硝酸的反应3Cu 8HNO3(稀)==== 3Cu(NO3)2 2NO↑ 4H2O
33.铁与浓硝酸的反应Fe 6HNO3(浓)==== Fe(NO3)3 3NO2↑ 3H2O
34.铁与稀硝酸的反应Fe 4HNO3(稀)==== Fe(NO3)3 NO↑ 2H2O
35.碳与浓硝酸的反应C 4HNO3(浓)==== CO2↑ 4NO2↑ 2H2O
36.一氧化氮与一氧化碳的反应2NO 2CO====== N2 2CO2
37.一氧化氮与氧气和水的反应4NO 3O2 2H2O==== 4HNO3
38.二氧化氮与氧气和水的反应4NO2 O2 2H2O==== 4HNO3
39.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH NO2 NO==== 2NaNO2 H2O
40.氨气(过量)与氯气的反应8NH3 3Cl2==== 6NH4Cl N2氨气(少量)与氯气的反应2NH3 3Cl2==== 6HCl N2
41.二氧化氮生成四氧化二氮的反应2NO2==== N2O4
42.硫与铜的反应S 2Cu==== Cu2S
43.硫与铁的反应S Fe==== FeS
44.硫与钠的反应S 2Na==== Na2S
45.硫与铝的反应3S 2Al==== Al2S3
46.硫与汞的反应S Hg==== HgS
47.硫与氧气的反应S O2==== SO2
48.硫与氢气的反应S H2==== H2S
49.硫与氢氧化钠的反应3S 6NaOH==== 2Na2S Na2SO3 3H2O
50.硫与浓硫酸的反应 S 2H2SO4(浓)==== 3SO2 2H2O
,