2.放热反应:燃烧、生石灰与水的反应(CaO H2O=Ca(OH)2)、镁和盐酸反应、酸碱中和反应。
3.溶于水吸热的是NH4NO3;溶于水放热的是NaOH、浓H2SO4;溶于水既不吸热也不放热的是NaCl。
第八单元:金属和金属材料
- 水银不是银是汞。
- 生铁和钢的性能不同:是因为含碳量不同。
- 混合盐溶液与一种金属发生置换反应的顺序是“先远”“后近”。
- 单质铁在置换反应中总是变为 2价的亚铁。
第九单元:溶液
- 汽油去油污的原理是:溶解
- 洗涤剂去油污的原理是:乳化
- NaOH去油污的原理是发生了化学反应
- 消毒酒精的溶质是:C2H5OH、溶剂是:H2O。碘酒的溶质是:I2、溶剂是C2H5OH。
- 溶液具有均一稳定性,但具有均一稳定性的物质不一定是溶液,比如水。
- 从饱和溶液转化为不饱和溶液,大多数固体是:升温、加水;Ca(OH)2固体是:降温、加水。
- 结晶通常有两种方法:
(1)蒸发结晶

(2)降温结晶法(冷却热饱和溶液法)

第十单元:酸和碱
- 正常雨水的pH<7。
- 酸雨的pH<5.6。
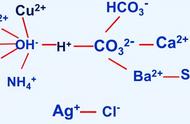
- 酸性溶液和酸溶液:酸性溶液是显酸性的溶液,包括酸、盐(如NH4Cl是盐,但是显酸性);而酸溶液指的就是酸。
- 碱性溶液和碱溶液:碱性溶液是显碱性的溶液,包括碱、盐(如Na2CO3是盐,但是显碱性);而碱溶液指的就是碱。
- 中和反应生成盐和水,生成盐和水的反应不一定是中和反应!比如酸 非金属氧化物=盐 水、碱 非金属氧化物=盐 水。
- 碱能使石蕊变蓝,使酚酞变红,但是难溶性的碱如Mg(OH)2、Cu(OH)2不能使之变色。
- NaOH能与非金属氧化物CO2、SO2、SO3能反应,但是并不代表NaOH能与所有的非金属氧化物反应,如NaOH不与CO反应,所以可以用NaOH溶液吸收CO中混有的CO2气体杂质。
- NaOH固体易吸收空气中的水分而潮解,用作干燥剂。NaOH溶液不可作干燥剂。
第十一单元:盐 化肥
- 纯碱不是碱,是盐(纯碱是碳酸钠Na2CO3)。
- 复分解反应的类型:
(1)金属氧化物 酸→盐 水
(2)中和反应(酸 碱→盐 水)
(3)酸 盐→新酸 新盐
(4)碱 盐→新碱 新盐
(5)盐 盐→新盐1 新盐2
第十二单元:化学与生活
1.有机物一定含有碳元素,但是含碳元素的化合物不一定是有机物,如CO、CO2、H2CO3、含CO32-的盐具有无机化合物的特征,属于无机化合物。
编辑整理by中学化学园,转载请注明出处!