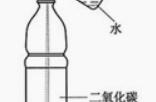
【方案评价】(2)两位同学中______________的方案正确。
【方案反思】(3)请分析错误方案的原因______________(都正确,不作答)。
【拓展研究】(4)请你再设计一个实验方案验证小尚的猜想正确,填写下列实验报告。

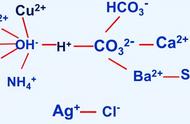
解析 (1)盐酸与氢氧化钠不能共存,因为如果二者都有会继续反应。(2)稀盐酸呈酸性,pH<7,氢氧化钠溶液呈碱性,pH>7,氯化钠溶液呈中性,pH=7,因此用测pH的方法来判断反应后溶液中的溶质是正确的。(3)稀盐酸和氢氧化钠反应会生成氯化钠,氯化钠溶液与硝酸银溶液反应也会生成不溶于稀硝酸的白色沉淀,因此小宫的方法是错误的。(4)小尚的猜想是溶液中有氯化钠和氢氧化钠,氯化钠是反应的生成物,是肯定有的,因此只要验证出有氢氧化钠即可,可根据氢氧根离子的性质进行验证。
答案 (1)盐酸与氢氧化钠溶液能发生反应(水溶液中H+、OH-不能大量共存) (2)小程 (3)中和反应产物有NaCl(Cl-),加入硝酸银溶液会生成白色沉淀,不能说明是否有HCl (4)方案步骤:取少量反应后的溶液于一支试管中,再向试管中滴加硫酸铜溶液(或其它可溶性铜盐溶液) 预估现象:有蓝色沉淀生成 (或取少量反应后的溶液于一支试管中,再向试管中滴加无色酚酞试液 酚酞试液变红色 或用一根洁净的玻璃棒蘸取反应后的溶液沾在pH试纸上,把试纸所呈现的颜色与标准比色卡进行对照 pH>7 或其它合理答案)
声明:本文来自“初中化学”,若涉及版权问题,请尽快联系删除,谢谢!