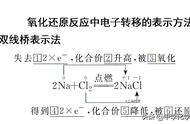
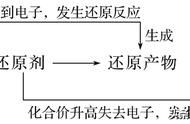
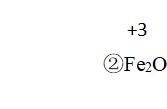同一氧化还原反应中,多种变价元素化合价发 生变化
当同一个氧化还原反应中有多种变价元素价态变 化时,产物判断的工具主要是:氧化性、还原性强弱的 比较和“上下楼梯考虑法”即就近原则。
例1、写出碘与氯水反应生成+5价碘的化学方程 式,标出电子转移的方向和数目。
分析:题目中给出的已知条件“生成+5价碘”大大 降低了本题的难度。如果题中没有这一条件的话,解决本题的几个步骤:
(1) 题中的碘元素和氯元素均是具有变价的ⅦA 族元素,碘元素常见价态参考氯元素;
(2) 氯气的氧化性强于碘单质,因此,在此反应中 氯气作氧化剂化合价降低生成HCl;
(3) 碘元素化合价升高,升至何种价态呢?解决这 一问题,回归至氧化还原反应的价态变化。

元素在被氧化的过程中,化合价升高一般是就近 原则,即每一次被氧化至它的相邻高价态,就像是在“踏踏实实地,一步一个脚印地爬楼梯”,若相邻高价不能稳定存在,则继续被氧化,化合价继续升高,直到它能稳定存在为止。这一题中,碘单质被氧化到+1价 的HIO,次碘酸不稳定,继续升高到+3价的HIO2,亚碘酸是极不稳定的物质,至今都没有制取到,碘元素化合价继续升高到+5价的HIO3,碘酸能稳定存在,所以,它的产物是碘酸。
即 I2+5Cl2+6H2O → 2HIO3+10HCl
硫、氮及其化合物的性质可将此就近原则诠释得相当到位:
例2 (1)硫及其化合物之间的相互转化:

纵观硫及其化合物的相互转化关系,物质之间的 变化主要通过化合价的变化实现。硫元素在被氧化的 过程中,化合价逐步上升至相邻高价;在被还原的过程中,化合价逐步降低至相邻低价。
例外的是标示数字①和②的两个反应。
①是硫化 氢气体的充分燃烧,看似硫元素的化合价由-2价升高 到了+4价,按照上述原则,硫元素必然经过0价,那它 为什么不在0价停留?氧气充足,硫单质继续被氧化, +4价的产物S02才能稳定存在。
②是工业制硫酸的第一步反应,假设FeS2中的硫 元素为-1价成立,按照上述原则,锻烧硫铁矿的产物 是单质硫,空气充足,单质硫继续被氧化,直至变为稳 定存在的SO2。那在氧气充足的情况下为什么就没有被 氧化为+6价而生成SO3呢?这与反应条件、活化分子 的多少有关,SO2转化为SO3必须要有催化剂的参与。
(2)氮及其化合物之间的相互转化:

所选物质均为氮元素常见价态代表物。在氮元素被氧化的过程中,基本遵循升高至相邻价态的原则。标示数字①的反应出现了化合价的跳跃,为什么?氨气是由氮气制得的,再由氨气去制取氮气,有意义吗?用催化剂使氮元素继续被氧化。
与此相似,当氮元素在被还原的过程中,同样降到它的相邻价态。标示数字②的反应出现了化合价的跳 跃。为什么稀硝酸和铜的反应中生成的是NO而不是 NO2 ?可以理解为:硝酸越稀,水越多,NO2和水反应了。 当然,在有硝酸参加的反应中,还要考虑硝酸的浓度对 其氧化性强弱的影响,硝酸的浓度越小,氧化性越弱, 生成的产物价态越低。
类似的反应有:氯气氧化单质铁,为什么铁元素化 合价不是升高到+2价?氯气的氧化性比三价铁氧化性强,它只能以+3价的产物存在。碳在足量氧气中燃烧, 为什么生成的产物是二氧化碳呢?不难发现,碳先生成 了一氧化碳,而一氧化碳在氧气中还能继续燃烧,所以 它的产物就只能是二氧化碳了。
综上所述,当氧化还原反应中出现了变价元素时, 我们要提取题目中有用的信息,分析其化合价变化的可 能情况,结合氧化性、还原性的强弱,回归氧化还原反应的实质,判断反应产物。
,