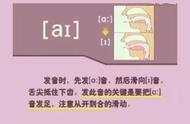
热力学第三定律是指当一个系统的温度趋于绝对零度时,其熵趋于定值或保持不变。(这个定值为零)该定律预测了处于绝对零度时系统的性质和熵的变化规律。
当一个独立的系统的温度趋向于绝对零度时,其熵趋于定值。

瓦尔特·能斯特的肖像
热力学是物理学中被广泛研究的一个重要分支。不同于令人头大的机械工程,热力学在生活中的应用是非常广泛的,小到空调制冷,大到工业革命的标志-蒸汽机,其工作机制均受热力学三大定律支配。热力学定律规定了做功、热量和能量是如何影响一个系统的。该系统是指宇宙中任何一个能发生能量转移的有界限的区域,该区域外的所有事物均是其周围环境。

系统的边界_热力学中所指的系统的插图。
(Photo Credit : Wavesmikey / Wikipedia Commons)
什么是熵?热力学第一定律暗示宇宙诞生时具有有限的可用的能量,处于其中的系统吸收能量后,会将一部分能量用于做功,另一部分能量用于增加系统内能,热力学第二定律详细探讨了这一过程。这一过程包括将有限的可用的能量转化为不可用的能量;例如:百亿年前随着宇宙逐渐冷却,物质逐渐产生的过程。在该过程中,一部分有限的可用的能量转化成了不可用的能量。
这一部分不可用的能量被一个称为“熵”的物理量来衡量,该参量反映了一个系统的随机程度或无序程度。

图解:熵无序增加的证据。
将宇宙看成一个杂乱无章地堆满衣服的房间,随着被穿过和废弃的衣服越来越多,房间越来越混乱,这一过程中系统的熵也逐渐增加。除非房间的主人做出努力,将衣服叠好并摆放整齐。房间主人的动作使系统的无序程度降低。