- 原子
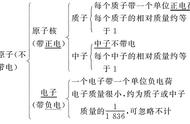
原子是构成物质的一种微粒。它的体积很小很小,不要“妄想”用肉眼看见它,然而它是真实存在的,有物质的地方都有它:今天的午饭、高楼大厦、云朵……都是由原子构成的。原子整体不显电性,分为原子核(带正电)和核外电子(带负电),原子核又是由带正电的质子和不带电的中子组成。核外电子带负电,原子核带正电,异种电荷相互吸引。由于原子内带正电的质子和带负电的电子数目相等,所以,整个原子是不显电性的。

电子在很“广阔”的空间里快速绕核旋转。在宇宙中,行星也是绕自己的恒星旋转,我一直觉得微观的世界和辽阔的宇宙有某些异曲同工之处呢!如果将整个原子比喻成大操场,那么原子核就是其中央的一个小石块儿。然而,整个原子的质量却是大部分都集中在原子核上。
同种原子中,质子数等于核外电子数,例如:硅原子中有14个质子,那么其外部就有14个电子。但是还有一个特例:那就是普通的氢原子内无中子,它里面只有一个质子。宏观元素的种类,也取决于其原子核内部的质子数。
- 相对原子质量
相对原子质量当然不是原子的实际质量了。国际上以碳12原子质量的十二分之一作为标准,将其他原子的质量和它相比较所得的值,作为这种原子的相对原子质量。(符号:Ar)公式是Ar=其他原子质量÷碳原子质量×1/12。那么,原子质量之比=相对原子质量之比。
- 离子
离子可以说是带电的原子,前面说原子是不显电性的,那么它是如何带电了呢?微小的电子在核外空间做高速运动。能量低的电子离核近,能量高的电子离核远。由于它们束缚电子的能力不同,在化学变化中,就会有的原子核得到电子,而有的会失去电子。
这里就很有必要说说原子的内部具体结构啦:首先我们先看下面蓝色的图1:氧原子核内有8个质子,核外电子排布第一层最多排两个电子,第二层最多排8个电子,若有后面的第三层亦是如此,但是最外层的电子一定不得超过8个。如果正好是8个,那它就是稳定结构。如果不是,那么它在化学变化中就容易失去或是得到电子。下面的氧原子结构示意图:我们可以看到核外电子有两层,第一层有2个电子。最外层电子数为6,大于4,也就是说,它在化学变化中易得到电子;

接下来我们再来看看化学变化中易失去电子的原子:以铝原子为例,下面红色图2展示:原子核内有13个质子。第一层2个电子,最外层3个,小于4,因此在化学变化中易失去电子。

那么现在我们可以来解释离子了:最外层电子数大于4或等于4,它在化学变化中易得到电子,就会显负电,称为阴离子;若最外层电子数小于4,它在化学变化中易失去电子,就会显正电,称为阳离子。
总结来说,阴离子:质子数<电子总数,带负电;阳离子:质子数>电子总数,带正电。
那么,由离子构成的物质在宏观上是带电的吗?也不是,因为物质中同时含有阴离子和阳离子,而且两种离子所带电荷的总量相等,因此物质在宏观上呈电中性。
,