阳离子和阴离子的区别
阳离子和阴离子是原子或分子中失去或获得电子的带电离子,阳离子带正电荷,如金属离子、氢离子等,在电解质溶液中具有较好的导电性和化学反应性,可以在溶液中进行电泳运动,同时也可以参与反应;阴离子带负电荷,如氯离子、氧离子等,在化学反应中常常与阳离子发生反应,它们的电荷相反,相互之间存在排斥力,因此阴离子的存在会导致溶液的酸碱性变化。
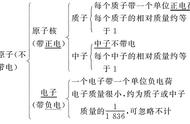
阳离子和阴离子的区别1. 电荷:阳离子带正电荷,阴离子带负电荷,这是它们最主要的区别之一。
2. 形成方式:阳离子是失去电子后形成的离子,如钠离子是由钠原子失去一个电子后形成的;阴离子是获得电子后形成的离子,如氢氧根离子是由氢原子失去一个电子后,与氧原子结合而形成的。
3. 原子半径:原子半径越大的原子其失电子能力越强,反之,原子半径越小的原子其吸收电子的能力也就越强,比如氯离子是因为氯原子的原子半径较大,所以具有较强的吸引电子的能力。
4. 原子最外层电子数:阳离子是失去电子后形成的离子,因此阳离子的最外层电子数比形成它的原子最外层电子数少,比如钠离子失去了一个电子,所以钠离子的最外层电子数为8-1=7;阴离子是获得电子后形成的离子,因此阴离子的最外层电子数比形成它的原子最外层电子数多,比如氢氧根离子获得了一个电子,所以氢氧根离子的最外层电子数为1 8=9。
5. 分析方法:阳离子在分析过程中容易起变化,主要采用分别分析方法,这是因为阳离子的反应活性较高,在分析时需要特别注意,避免发生副反应。阴离子的分析相对简单,因为阴离子的反应活性相对较低,所以阴离子的分析一般采用直接分析方法,不需要特别的处理。
常见的阳离子有Na⁺、K⁺、NH⁴⁺等,阴离子有SO₄²⁻、SiO₃²⁻等,这些离子在化学和生命领域都有广泛的应用。阳离子聚合反应和阴离子聚合反应是合成高分子化合物的重要反应,它们的形成和性质与离子键密切相关。
离子键是由阳离子和阴离子之间的静电吸引力相互结合形成的强共价键,对于物理和生命系统的运作具有重要的影响。
,