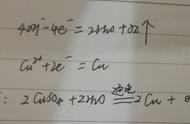【学习目标】
- 能记住铁、铝、铜等常见金属的化学性质。
- 理解金属活动性顺序的意义。
- 会根据金属活动性顺序解释一些常见的问题。
【学习过程】
一、预习导学
.1.写出镁、铝、铁、铜与氧气反应的化学方程式,通过它们与氧气反应的难易程度初步比较其活动性顺序。
2. 为什么铝具有很好的抗腐蚀性能?
3. 我们常说“真金不怕火炼”。请您从化学的角度谈谈对这句话的理解。
二、课堂研讨
1.通过探究实验,完成下表:
金属 | 反应现象 | 化学方程式 | |
稀盐酸 | 稀硫酸 | ||
镁 | |||
铝 | |||
锌 | |||
铁 | |||
铜 与酸发生反应
小结:(1)比较上表反应现象,可以说明五种金属的活动性顺序由强到弱排列为:
(2)分析上面的反应方程式的特点:他们的反应物和生成物中都有一种
和一种 ,这种反应叫做 反应。
2.金属与盐溶液的反应
(1)把铝丝插入硫酸铜溶液中
方程式:
现象:
(2)把铁丝插入硫酸铜溶液中
方程式:
现象:
(3)把铜丝插入硝酸银液中
方程式:
现象:
三、延伸拓展
1.常见金属的活动性顺序为:K、Ca、Na、 、 、 、 、Sn、Pb、(H)、 、 、 、Pt、Au
2.金属活动性顺序的主要应用:
①在金属活动性顺序里,金属的位置越靠前,它的活动性就越强 。
②在金属活动性顺序里,位于____前的金属能够置换出盐酸和稀硫酸中的____。
③在金属活动性顺序里,位于 的金属能把位于 的金属从它的盐溶液中置换出来。
【学习小结】
,