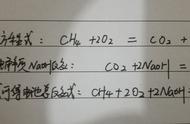在学习电解原理时,对于有水参与的电极反应式的书写,有时要写成H 或OH-放电形式,有时要写成H2O的形式。对此,同学们感到困惑。现总结了如下规律,仅供参考。

一、分析问题
对于电解有水参与的电解质溶液有两类,我们可先写出其电极反应,分析一下有H 或OH-放电的电极反应中H 或OH-的来源,进一步探究有水参与的电极反应式的书写规律。
1、电解水性(阳极为惰性电极)
⑴电解强碱溶液(如NaOH溶液)
其电极反应式分别为:
阳极反应:4OH--4e-=2H2O O2↑(OH-来自于NaOH的电离)
阴极反应:2H 2e-=H2↑(H 来自于水的电离)
因为阴极反应的H 来自于水的电离,2H2O==2H 2OH- ①,2H 2e-=H2↑②,两式相加得2H2O 2e-=H2↑ 2OH-,所以其阴极反应还可以写成2H2O 2e-=H2↑ 2OH-的形式。若要写电解总反应式,其阴极反应必须写成2H2O 2e-=H2↑ 2OH-的形式,根据电子守恒,将阴、阳两极反应相加的电解总反应式为2H2O== 2 H2↑ O2↑。
⑵电解含氧酸溶液(如H2SO4溶液)
其电极反应式分别为:
阳极反应:4OH--4e-=2H2O O2↑(OH-来自于水的电离)
阴极反应:2H 2e-=H2↑(H 来自于H2SO4的电离)
因为阳极反应的OH-来自于水的电离,4H2O==4H 4OH- ①,4OH--4e-=2H2O O2↑②,两式相加得2H2O-4e-=4H O2↑,所以其阳极反应还可以写成2H2O-4e-=4H O2↑的形式。若要写电解总反应式,其阳极反应必须写成2H2O-4e-=4H O2↑的形式,根据电子守恒,将阴、阳两极反应相加的电解总反应式为2H2O==2 H2↑ O2↑。
⑶电解活泼金属的含氧酸盐溶液(如Na2SO4溶液)
其电极反应式分别为:
阳极反应:4OH--4e-=2H2O O2↑(OH-来自于水的电离)
阴极反应:2H 2e-=H2↑(H 来自于水的电离)
因为阴极、阳极反应中的H 、OH-均来自于水的电离,则上述阳极反应还可以写成2H2O-4e-=4H O2↑的形式,阴极反应还可以写成2H2O 2e-=H2↑ 2OH-的形式。若要写电解总反应式,其阳极反应必须写成2H2O-4e-=4H O2↑的形式,阴极反应必须写成2H2O 2e-=H2↑ 2OH-的形式,根据电子守恒,将阴、阳两极反应相加的电解总反应式为2H2O==2 H2↑ O2↑。
故电解上述三类电解质溶液的实质都是电解水。

2、电解盐和水型(阳极为惰性电极)
⑴电解活泼金属的无氧酸盐溶液(如NaCl溶液)
其电极反应式分别为:
阳极反应:2Cl--2e-=Cl2↑
阴极反应:2H 2e-=H2↑(H 来自于水的电离)
因为上述阴极反应的H 来自于水的电离,所以其阴极反应还可以写成2H2O 2e-=H2↑ 2OH-的形式。若要写电解总反应式,其阴极反应必须写成2H2O 2e-=H2↑ 2OH-的形式,根据电子守恒,将阴、阳两极反应相加的电解总反应式为2Cl- 2H2O==Cl2↑ H2↑ 2OH-。
⑵电解不活泼金属的含氧酸盐溶液(如CuSO4溶液)
其电极反应式分别为:
阳极反应:4OH--4e-=2H2O O2↑(OH-来自于水的电离)
阴极反应:Cu2 2e-= Cu
因为上述阳极反应的OH-来自于水的电离,所以其阳极反应还可以写成2H2O-4e-=4H O2↑的形式。若要写电解总反应式,其阳极反应必须写成2H2O-4e-=4H O2↑的形式,根据电子守恒,将阴、阳两极反应相加的电解总反应式为2Cu2 2H2O==2Cu 4H O2↑。
故电解上述两类电解质溶液的实质都是盐和电解水。
二、总结规律
通过上述有水参与的电解质溶液的电解原理分析,其电极反应式的书写规律归纳如下:
1、在酸溶液中,阴极反应必须写成H 放电的形式,阳极反应既可写成OH-的放电形式,又可写成H2O的形式(因为OH-来自于水的电离),如上述电解H2SO4溶液的电极反应。
2、在碱溶液中,阳极反应必须写成OH-放电的形式,阴极反应既可写成的H 放电形式,又可写成H2O的形式(因为H 来自于水的电离),如上述电解NaOH溶液的电极反应。
3、在盐溶液中,有水参与的电极反应,既可写成的H 或OH-放电形式,又可写成H2O的形式(因为H 或OH-来自于水的电离),如上述电解Na2 SO4、NaCl、CuSO4溶液的电极反应。
,