这节内容较难从课本上看,没什么难的,但和初中化学基础关联较大,且有些疑难概念需要认真辨析。
第一节 物质的分类
教材截图


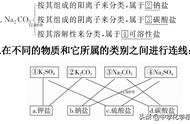
1 交叉分类法
含义:根据不同的分类标准,对同一事物进行多种分类的方法,即对同一物质以不同的标准进行分类。
例:


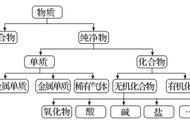
2 树状分类法
含义:对同类事物按照某种属性进行再分类的分类法。
例

3、【补充知识】认识氧化物的几个“一定”与“不一定”!
(1)碱性氧化物一定是金属氧化物!但金属氧化物不一定是碱性氧化物!(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2 为过氧化物)。
(2)酸性氧化物不一定是非金属氧化物!(如Mn2O7);非金属氧化物也不一定是酸性氧化物!(如CO、NO)。
(3)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱!(如SiO2、Fe2O3)
(4) 与水反应生成酸的氧化物不一定是酸性氧化物,如NO2;与水反应生成碱的氧化物不一定是碱性氧化物,如Na2O2。
(5)酸性氧化物都是对应酸的酸酐,但酸酐不一定都是酸性氧化物!如乙酸酐[(CH3CO)2O]。
如CO2是H2CO3的酸酐。
某含氧酸脱去一分子水或几分子水,所剩下的部分称为该酸的酸酐。
4、【重要概念】同素异形体
同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:
(1)组成分子的原子数目不同,例如: O2和O3 。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
1.符合如图中阴影部分的物质是( )

A.NaHCO3 B.Cu2(OH)2CO3
C.NaCl D.Na2CO3
【答案】 D
2.按照物质的树状分类法和交叉分类法,HNO3应属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸
⑤难挥发性酸 ⑥一元酸 ⑦化合物 ⑧混合物
A.①②③④⑤⑥⑦ B.①④⑥⑦
C.①⑧ D.①④⑤⑥
【答案】 B
3.同一种物质按照不同的分类标准可以分为很多类别,按照物质的成分对下列10种物质进行分类:
①水 ②空气 ③铁 ④二氧化碳 ⑤硫酸 ⑥熟石灰[Ca(OH)2] ⑦胆矾(CuSO4·5H2O) ⑧食盐水 ⑨碱式碳酸铜[Cu2(OH)2CO3] ⑩硫酸氢钠(NaHSO4)
(1)属于混合物的是_____________________________________________;
(2)属于氧化物的是_____________________________________________;
(3)属于碱的是_________________________________________________;
(4)属于酸的是_________________________________________________;
(5)属于盐的是_________________________________________________;
(6)属于铜盐的是_______________________________________________;
(7)属于钠盐的是_______________________________________________;
【答案】 (1)②⑧ (2)①④ (3)⑥ (4)⑤ (5)⑦⑨⑩ (6)⑦⑨ (7)⑩
【题后反思】
①溶于水能电离出H+的化合物不一定是酸,如NaHSO4;溶于水能电离出OH-的化合物不一定是碱;如Mg(OH)Cl;盐的构成中不一定仅有金属阳离子和酸根阴离子,如NH4Cl,非金属元素可形成阳离子NH;酸根离子中不一定只有非金属元素,如MnO。
②酸分子中有几个H原子,不一定就是几元酸,如CH3COOH是一元酸。
(3)单质、纯净物和混合物
由同种元素组成的物质不一定是单质,也可能属于混合物,如O2和O3的混合气体是混合物;只有由同一种元素组成的纯净物才属于单质
,