烃是指仅含碳和氢两种元素的有机化合物,又称碳氢化合物。
烃的种类较多,最常见的、也是最重要的烃有:
烷烃(饱和链烃),代表物甲烷(CH4);
烯烃,代表物乙烯(CH2=CH2);
炔烃,代表物乙炔(CH≡CH);
芳香烃,代表物苯(C6H6)。
烃分子中碳原子的饱和程度、化学键的类型决定了烃分子的断键位置和反应类型,也就是烃分子的结构决定了烃的化学性质。
日常生活中常见的一些物质,如天然气、液化石油气、汽油、柴油、凡士林、石蜡等,其主要成分都是烷烃。
烷烃的结构和性质我们已经学习过甲烷的有关知识,下面我们参照甲烷的组成、结构、性质来学习烷烃的组成、结构、性质和用途。
- 烷烃的组成、结构
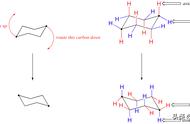
观察下面几种简单的烷烃(依次为甲烷、乙烷、丙烷、正丁烷、正戊烷,蓝球代表碳原子、白球代表氢原子)分子结构模型,写出它们的分子式、结构式和结构简式,并分析它们在组成和结构上的相似之处。

甲烷、乙烷、丙烷、正丁烷、正戊烷的球棍模型
名称 | 分子式 | 结构简式 | 碳原子的杂化方式 | 共价键的类型 |
甲烷 | CH4 | CH4 | σ键 | |
乙烷 | C2H6 | CH3CH3 | σ键 | |
丙烷 | C3H8 | CH3CH2CH3 | σ键 | |
正丁烷 | C4H10 | CH3(CH2)2CH3 | σ键 | |
正戊烷 | C5H12 | CH3(CH2)3CH3 | σ键 |
链状烷烃的分子式符合通式:
CnH2n+2(n≥1,正整数)。
烷烃的结构特点:
与甲烷的相似,碳原子都采取杂化,C—C、C—H都是σ键,都是共价单键,C—C是非极性键,C—H是极性键。

甲烷中碳原子的杂化原子轨道和棒状模型
以碳原子为中心的四面体结构(甲烷是正四面体),碳链就是一个个的四面体连接而成,所以碳骨架是锯齿状,碳原子并不在一条直线上。
烷烃的结构相似,分子组成相差一个或若干个CH2原子团,所以把烷烃叫做同系物。结构相似,组成相差一个或若干个CH2的有机物称为同系物。同系物的组成和结构相似,所以其性质相似。
二、烷烃的性质
复习甲烷的物理性质及化学性质。
无色无味的气体,难溶于水,密度比空气小。
甲烷的化学性质比较稳定,通常不能使酸性高锰钾溶液褪色,也不与强酸、强碱及溴的四氯化碳溶液反应。但可以在空气中燃烧,与氯气光照可以发生取代反应,高温下能分解。

根据烷烃分子结构,推测其它烷烃的物理性质和化学性质。
烷烃中的碳原子都是杂化,形成了4个杂化轨道,然后碳原子之间、碳原子与氢原子之间结合,其共价键都是σ键。这种结构决定了它们的物理性质、化学性质都与甲烷相似。
物理性质:
烷烃都是由分子构成,熔、沸点都不高,但随着碳原子数目增多,相对分子质量增大,分子间作用力增强,沸点逐渐升高。
同分异构体中,有支链的分子间作用力小,支链越多分子间作用力越小,则沸点越低。