1、探究浓度、温度对化学平衡的影响,加深对平衡移动原理的理解。
2、理解控制变量、对比等研究方法。
探究原理:1、增大反应物的浓度或减小生成物的浓度,平衡向正反应方向移动;减小反应物的浓度或增大生成物的浓度,平衡向逆反应方向移动。
2、升高温度,平衡向吸热反应的方向移动;降低温度,平衡向放热反应的方向移动。
探究内容:一、浓度对化学平衡的影响
1、FeCl3溶液与KSCN溶液的反应
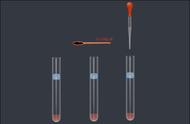
(1)在烧杯中加入10 mL蒸馏水,再滴入5滴0.05 mol/L FeCl3溶液、5滴0.15 mol/L KSCN溶液,用玻璃棒搅拌使其充分混合,得到红色溶液,分装到a、b、c三支试管中。
(2)向试管a中滴入5滴0.05 mol/L FeCl3溶液,向试管b中滴入5滴0.15 mol/L KSCN溶液,观察实验现象,与试管c进行对比。
(3)试管a中溶液红色加深,试管b中溶液红色加深。说明其他条件不变时,增大反应物的浓度,平衡向正反应方向移动。
(4)继续向上述a、b两支试管中分别加入少量铁粉,充分反应观察。
(5)两支试管中溶液红色均变浅。说明其他条件不变时,减小反应物的浓度,平衡向逆反应方向移动。
原因分析:
红色溶液中存在化学平衡(以下面平衡为例):

试管a中增大,试管b中增大,即反应物浓度增大,平衡正向移动,生成物Fe(SCN)3浓度增大,红色加深。
向试管a、b中加入少量铁粉,会发生反应

使减小,即反应物浓度减小,平衡逆向移动,生成物Fe(SCN)3浓度减小,红色变浅。
2、在K2Cr2O7溶液中存在如下平衡:

(1)在试管中加入2 mL 0.1 mol/L K2Cr2O7溶液,向试管中滴加5~10滴6 mol/LNaOH溶液。
(2)溶液变为黄色,说明其他条件不变时,减小生成物的浓度,平衡向正反应方向移动。
(3)向试管中继续滴加5~10滴6 mol/LH2SO4溶液。
(4)溶液由黄色变为橙色,说明其他条件不变时,增大生成物的浓度,平衡向逆反应方向移动。
原因分析:
向溶液中滴入NaOH溶液,减小了,即减小了生成物浓度,平衡向正反应方向移动;向溶液中滴入H2SO4溶液,增大了,即增大了生成物浓度,平衡向逆反应方向移动。