考点6:判断物质结晶的方法

考点7: 温度改变时,溶液中各种量的变化情况
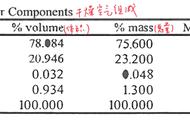
如:t3℃时,将相同质量的甲、乙、丙的饱和溶液同时降温到t1℃,则下列说法正确的是(C )
A. 溶质质量分数:乙<丙
B. 溶剂质量:甲>乙
C. 溶质质量:乙>丙
D. 溶液质量:甲>丙
■ 方法指导:饱和溶液温度变化时:
(1)物质的溶解度随温度的升高而增大(即曲线为上升型)。
① 若将饱和溶液降低温度,由于析出晶体,溶液中溶质质量减小,溶剂质量不变,溶液质量减小,因此溶质质量分数变小。
② 若将饱和溶液升高温度,饱和溶液变为不饱和溶液,溶液中溶质、溶剂质量均不变,因此溶质质量分数也不变。
(2)物质的溶解度随温度升高而减小(即曲线为下降型)。改变温度时,溶液中溶质、溶剂、溶液的质量,溶质质量分数变化情况与上述分析相反。


(1)同一物质,不同温度下的溶解度。
如氯化钠在10℃时溶解度为35.8g,在30℃时溶解度为36.3g。
(2)不同物质,在同一温度下的溶解度。
如20℃时,氯化钠的溶解度为36.0 g,硝酸钾的溶解度为31.6g,氢氧化钙的溶解度为0.165 g。
(3)根据不同温度下溶解度的变化情况,判断物质的溶解度随温度的变化趋势。(仅变化趋势、不做数据对比)
如氯化钠的溶解度变化趋势为随温度升高,溶解度增大,但是幅度较小;
硝酸钾的溶解度变化趋势为随温度升高增长幅度较大;
氢氧化钙的溶解度变化趋势为随温度增大而减小 。
考点2:溶解度表的应用
以表格数据形式考查两种物质(如NaCl和KNO3)溶解度相等的温度范围为20℃~ 30℃ 。
■ 方法指导:根据溶解度表,通过对比两种物质的溶解度,20℃以前,NaCl的溶解度大于KNO3,30℃以后,NaCl的溶解度小于KNO3,则NaCl和KNO3 溶解度相等的温度范围一定在20℃~ 30℃之间。