1、定义:酸和碱作用生成盐与水的反应叫做中和反应。
2、实质:酸溶液中的氢离子和碱溶液中的氢氧根离子结合成水。
3、改良土壤:如改良酸性土壤中可加入熟石灰,改良碱性土壤可以加入碳酸水。
4、处理工厂废水:含有稀硫酸的废水可用熟石灰来中和,反应的方程式是H2SO4+Ca(OH)2=CaSO4+2H2O
5、用于医药:用含氢氧化铝或氢氧化镁的药物中和过多的胃酸:
Al(OH)3 3HCl=AlCl3 3H2O Mg(OH)2 2HCl=MgCl2 2H2O
小苏打、墨鱼骨粉(主要成分是碳酸钙)也可以治疗胃酸过多,但它们不属于中和反应。
6、被蚊虫叮咬时涂含氨水(或者是牙膏、肥皂水)的药物。
7、中和反应同氧化反应、还原反应一样,是特征反应,不属于四大基本反应类型。
8、溶液的酸碱度常用pH表示。pH范围通常在0~14之间;pH<7的溶液显酸性,pH越小,酸性越强;pH=7的溶液显中性;pH>7的溶液显碱性,pH越大,碱性越强。
9、加水稀释只能使酸性或碱性溶液的pH无限靠近7,但不能改变溶液的酸碱性。
10、测定方法:用玻璃棒蘸取被测液,滴到PH试纸上,pH试纸显色后与标准比色卡比较可得出溶液的pH。
11、不能把pH试纸浸在待测液体中。
12、pH试纸不能用水润湿。
13、pH试纸测出的pH值是整数。
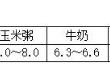
14、在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长。
15、测定雨水的pH(因溶解有CO2,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况。
例1.下列四种物质中,在一定条件下能与其它三种物质发生反应的是( )
A. CuSO4 B.CO2
C.NaOH D.H2SO4
解析:2NaOH CuSO4 =Cu(OH)2 ↓ Na2SO4 2NaOH CO2= Na2CO3 H2O
2NaOH H2SO4=Na2SO4 H2O
答案:C
例2.下列关于酸、碱、盐说法正确的是( )
A.pH大于7的溶液一定是碱的溶液
B.碱溶液与盐溶液发生复分解反应后,溶液的总质量不变
C.浓硫酸敞口放在空气中溶质质量分数会变小的原因是浓硫酸易挥发
D.能使紫色石蕊试液变蓝的溶液一定能使无色酚酞试液变红
解析:A.pH大于7的溶液不一定是碱的溶液,还有可能是盐的溶液,故A错误;B.碱溶液与盐溶液发生复分解反应,生成物总有气体或沉淀,故反应后溶液的总质量减少,故B错误;C.浓硫酸易吸水,敞口放在空气中会因为吸收空气中的水分而使其溶质质量分数变小,故C错误;D.能使紫色石蕊试液变蓝的溶液是碱性溶液,也能使无色酚酞试液变红,故D正确。故选D。
答案:D
例3.物质的性质决定其用途。下列物质的用途与性质对应关系错误的是( )
A.氢氧化钙可用来改良酸性土壤——氢氧化钙溶液呈碱性
B.氮气常用作保护气——氮气化学性质稳定
C.固态二氧化碳可用于人工降雨——二氧化碳能与碱反应
D.氧化钙可做食品干燥剂——氧化钙能与水反应
答案:C
例4.鱼胆弄破后会使鱼肉粘上难溶解于水的胆汁酸(一种酸)而变苦,要减少这种苦味,用来洗涤的最佳物质是( )。
A.水 B.食盐 C.纯碱 D.食醋
答案:C
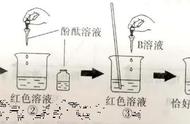
例5.下列变化不能表明盐酸与氢氧化钠发生了反应的是( )
A. 向氢氧化钠溶液中加入盐酸后,混合溶液的温度升高
B.向氢氧化钠溶液中加入盐酸后,混合溶液的质量增大
C. 向滴有酚酞的氢氧化钠溶液中加入盐酸后,红色褪去
D.向氢氧化钠溶液中加入盐酸后,混合溶液的pH<7
答案:B
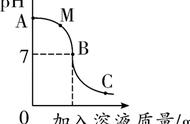
例6.向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。小烧杯中有关量的变化情况见下图。其中肯定不正确的是( )

答案:B
例7.研究氢氧化钠性质实验中的部分实验及现象记录如下,其中现象不合理的是( )

答案:C
例8.下列推理正确的是( )
A.某固体化肥与熟石灰研磨产生氨味,可证明该化肥一定是铵态氮肥
B.酸雨的pH小于7,pH小于7的雨水一定是酸雨
C.唾液淀粉酶是生物催化剂,能催化生成体内的所有化学反应
D.利用洗洁精和汽油来清除衣服上的油污都属于乳化作用
答案:A
例9.胃酸能帮助消化,但过多的胃酸会危害健康。可用于治疗胃酸过多的物质是( )
A.NaCl B.Al(OH)3 C.CaO D.NaOH
答案:B
例10.下列实验方案或措施中,不能达到目的是( )
A.用CO2鉴别NaOH溶液和Ca(OH)2溶液
B.用水鉴别硝酸铵固体和氢氧化钠固体
C.用无色酚酞试液检验NaOH溶液是否变质
D.用过滤的方法从H2O2溶液制氧气的残余物中分离出MnO2
答案:C
例11.凤凰”号火星探测器测得火星北极的土壤呈弱碱性,如果火星具备作物生长的条件,下列作物较适宜在火星北极种植的是( )