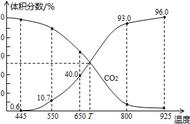
高中化学中的简答题常以化学实验、化学反应原理、工艺流程这三种类型的大题题型为载体,主要考查的是化学平衡移动原理的相关知识,对实验目的、现象、操作流程的描述。

(1)答题要点:
①会写可逆反应的方程式(附带考察离子反应方程式的配平及电荷守恒)。
②改变的条件。
答:三个因素:温度 压强 浓度 注意:催化剂只改变反应速率
③平衡如何移动。
答:勒夏特列原理,可以理解为平衡移动是个叛逆的孩子,永远反着来。
④平衡移动造成了什么后果。
答:反应方向的改变,包括:正逆方向的改变,吸放热方向的改变,体积大小方向的改变
(2)得分点及回答套路
解答此类题目要注意解答顺序:
①先说明反应为可逆反应:写出化学方程式或离子方程式(一般在叙述的时候不用写,除非题目要求)
②然后说明条件变化情况:只考虑“一个条件”变化,其他条件不变。(默认控制变量法)
③再说明平衡移动方向:正向(或逆向)移动,吸热(放热)方向移动,体积变大(小)方向移动
④最后说明平衡移动结果:某些物理量发生了什么变化或造成了哪些影响
我们来看一下例题:

然后我们根据“套路”进行回答
①先说明反应为可逆反应:
因为该反应为可逆反应(题干中已给方程式,就可以不用再写一遍了)
②然后说明条件变化情况:
因为该反应为正向放热,且在绝热密闭的容器中(说明其他条件不变,默认控制变量),随着反应的进行,容器内的温度逐渐升高
③再说明平衡移动方向:
所以平衡向吸热方向移动,而吸热方向为逆方向
④最后说明平衡移动结果:
所以NO的转化率降低
最后我们总结“套路”里的四个回答:
该反应为正向放热的可逆反应,且在绝热密闭的容器中,随着反应的进行,容器内的温度逐渐升高,平衡向逆向吸热方向移动,所以NO的转化率降低。
这就完美的把这道简答题解决了~
我们再来看一道题:

同样的我们用来“套路”回答一下:
①先说明反应为可逆反应:
因为SO2反应生成SO3为可逆反应
②然后说明条件变化情况:
因为该反应为正向放热,随着反应的进行,沸腾炉内的温度逐渐升高
③再说明平衡移动方向:
所以平衡向吸热方向移动,而吸热方向为逆方向
④最后说明平衡移动结果:
所以SO3的产量减少,从而导致CuSO4的量减少
最后我们总结“套路”里的四个回答:
因为SO2反应生成SO3为正向放热的可逆反应,随着反应的进行,沸腾炉内的温度逐渐升高,平衡向逆向吸热方向移动,所以SO3的产量减少从而导致CuSO4的量减少。
这就完美的也把这道简答题解决了~
接下来,同学们自己试一下这个答题“套路”



由于篇幅有限,文章中给几道相关的题,欢迎在评论区留言回答,如需要跟多相关题型,可私信给我。
最后,祝大家学习进步!
希望各位同学能点赞,转发,评论,关注 。
谢谢!
加关注,不走丢哦~
,