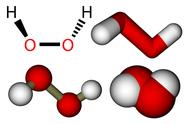
(2)天然气是清洁能源和重要的化工原料,主要成分是甲烷,3个甲烷分子表示为__________。
(3)草酸(H2C2O4)是重要的化工原料,草酸中碳元素的化合价为__________。
(4)黑火药是我国古代四大发明之一,原料中有硝酸钾,它也是一种复合肥,由K 与NO3-
构成,请写出硝酸钾的化学式__________。
14. (5分)(1)氢气由于热值大、来源广、燃烧产物无污染,得到人们积极的开发和利用。请写出氢气在空气中燃烧的化学方程式____________________。
(2)碳元素可形成多种单质,如金刚石、石墨、C60,焦炭和活性炭的主要成分也是碳的单质。制糖工业的脱色制白糖、防毒面具里的滤毒罐等都使用了活性炭,这是利用了活性炭有较强的____________性。
(3)铁合金有广泛的用途,碳元素含量越高,铁合金硬度就越大,则钢和生铁中硬度较大的是___________。
(4)焦炭、CO是冶金工业重要的还原剂,请写出用赤铁矿(主要成分Fe2O3) 和CO反应炼铁的化学方程式____________________。
(5)生活中有许多小窍门能让人们避开危险,减少损失,如炒菜时油锅中的油不慎着火,请举一种灭火的方法_____________________。
15. (3分)溶液在日常生活、工农业生产和科学研究中具有广泛的用途。某同学在研究甲、乙(均不含结晶水)两种物质在水中的溶解度与温度的关系时,绘制了如下溶解度曲线,请回答下列问题:

(1)图中M点的含义是__________。
(2)t1℃时,把含有甲、乙物质各60g的混合物投入到100g水中,升温至t2℃时,充分搅拌,趁热过滤,得到的固体是_____。( 选填“甲”或“乙”)
(3) t2℃时,一定质量甲物质的饱和密液,从t2℃降温至t1℃,析出30g甲,则该溶液中溶剂水的质量为_____。
16. (5分)黄铜(铜锌合金)长期使用会锈蚀,铜锈主要成分为Cu2(OH)2CO3。 查阅资料:铜锈可以与稀硫酸反应,其化学方程式为: Cu2(OH)2CO3 2H2SO4=2CuSO4 3H2O CO2↑,杂质不与稀硫酸反应。回收废黄铜有用成分,调配锌铜比例,可以铸造新的黄铜,变废为宝。其工艺流程图如下:

(1)步骤一、步骤二、步骤三中均有混合物分离的操作,且方法相同,分离需要的玻璃仪器除漏斗、烧杯外,还需要______。(填玻璃仪器名称)
(2)化学反应按反应物和生成物的种类与特点分为四大基本反应类型,请写出步骤三中的主要化学方程式_______________,其反应类型是__________。
(3)系列处理二后获得锌的质量________原废黄铜中锌的质量。(选填“<”“=”或“>”)
(4)黄铜颜色与黄金相似,人称“愚人金”,常被不法商贩冒充黄金牟取暴利。下列选项中不能区别黄铜与黄金的方法是________。
A.用磁铁吸引 B.浸入稀盐酸溶液,观察有无气泡
C.在空气中灼烧后观察颜色 D.测定密度大小
三、计算题(本题5分)
17.我国科学家侯德榜发明了联合制碱法,为世界科学发展做出了重要贡献。该制碱法以食盐为原料制备纯碱,产品中会混有少量氯化钠。某学习小组为了探测产品中纯碱的质量分数,将5g纯碱样品溶于20g水中配成溶液,再加入30g氯化钙溶液恰好完全反应( Na2CO3 CaCl2=CaCO3↓ 2NaCl),反应后静置、过滤、洗涤、干燥,称得沉淀质量为4.5g。请回答下列问题:
(1)过滤后的滤液质量为_________g。(1分)
(2)求纯碱样品中纯碱的质量分数。(写出计算过程)(4分)
四、实验探究题(本题共2小题,每空1分,共10分)
18. (5分)二氧化碳是温室气体之一,“节能减排”“碳达峰”“碳中和”等关键词成为热搜。
(1)某化学兴趣小组设计实验验证二氧化碳温室效应。如图一所示,他们选用体积大小相等的两个塑料瓶,分别盛满同条件下的空气、二氧化碳与空气的混合物(体积比1: 1),并用一个小塑料管连接(在塑料管中间有一滴红墨水),置于阳光下。一段时间后红墨水滴会________移动。(选填“向右”“向左”或“不”)

(2 )实验室用大理石与稀盐酸反应制备二氧化碳气体,其气体发生装置应选用图二中的_______(填序号)。收集二氧化碳气体时,验满的方法是________________。
(3)若实验室选用A装置制备氧气,其反应的化学方程式为____________________。
(4)氨气通常情况下是无色、有刺激性气味、极易溶于水、密度比空气小的气体。若用上图二中D装置收集氨气,进气口应是________。(选填“a”或“b”)
19. (5分)某课外化学兴趣小组到华蓥山石林研学旅行,震惊于溶洞内千姿百态的石笋、钟乳石。回校后查阅教材,知道溶洞都分布在石灰岩组成的山洞中。石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙,其反应方程式为:CaCO3 CO2 H2O=Ca(HCO3)2。当溶有碳酸氢钙的水遇热或压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来。
【提出问题】兴趣小组在研究溶洞成因后提出:
在碳酸钠溶液中通入二氧化碳气体也会发生类似的反应吗?
推测反应方程式为:Na2CO3 H2O CO2=2NaHCO3
【猜想与假设】同学们做出了如下猜想:
猜想一:碳酸钠、二氧化碳和水会发生反应。
猜想二:______________________。
【查阅资料】①碳酸氢钠受热会分解产生碳酸钠、水和二氧化碳;
②碳酸钠与碳酸氢钠相互不反应。
【实验方案设计】
第一步:制备检测样品。向盛有Na2CO3溶液的烧杯中通入一定量的二氧化碳后,通过系列的操作制得了固体,并干燥固体待用。
第二步:将第一步制得的固体加热,以检验固体中是否有碳酸氢钠。