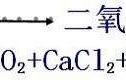一、高频考点
二、考试要求
能正确书写化学方程式
考点、书写的步骤
三、考查
07---09年
考点内容 | 考查年份 | 题号 | 分值 | 题型 | 考查方式 |
化学方程式书写 | 09山西 | 15 | 4 | 填空题 | 以推断题的形式考查化学方程式的书写 |
17 | 2 | 实验探究题 | 通过探究干燥剂是否变质考查化学方程式的书写 | ||
09太原 | 18 | 4 | 填空题 | 以推断题的形式考查化学方程式的书写 | |
19 | 4 | 填空题 | 考查盐酸与碳酸钡反应的化学方程式书写 | ||
20 | 4 | 实验探究题 | 考查氧气的制备原理以及铁丝在氧气中燃烧的化学方程式 | ||
21 | 2 | 实验探究题 | 考查盐酸与氧化铁反应的化学方程式 | ||
08山西 | 13 | 4 | 填空题 | 考查炼铁原理以及甲烷燃烧的化学方程式 | |
15 | 4 | 填空题 | 以推断题的形式考查化学方程式的书写 | ||
08太原 | 16 | 2 | 填空题 | 通过碳酸饮料考查二氧化碳和水反应 | |
17 | 4 | 填空题 | 考查铝与氧气盐酸反应的化学方程式书写 | ||
07山西 | 14 | 3 | 填空题 | 考查胃酸与氢氧化镁的京戏及铁与硫酸铜反应 | |
16 | 1 | 实验探究题 | 以推断题的形式考查化学方程式的书写 | ||
17 | 1 | 实验探究题 | 给出发生仪器,考查反应原理 | ||
07太原 | 16 | 2 | 填空题 | 考查利用硫酸分离铜锌合金的原理 | |
17 | 2 | 填空题 | 以推断题的形式考查化学方程式的书写 | ||
19 | 2 | 填空题 | 考查酸与碱盐氧化物、单质的反应 | ||
07太原 | 22 | 5 | 计算题 | 过氧化氢分解反应的计算 |
化学方程式这部分内容除了常见的、各省市必考的按要求书写化学方程式,判断化学方程式的正误,以及由所提供信息书写化学方程式,出题的形式大多是选择题、填空题,分值多为1—4分。 本单元各部分内容中,在中考中所占地位最为重要的当属根据化学方程式的简单计算。近几年来,只是单纯依据化学方程式进行计算的试题越来越少,大都与溶液的计算、实验探究相联系,在整张试卷中,一般都处于“压轴题”的位置,难度较高,分值较大,能否正确解答,是获得高分的关键。以往对化学方程式意义及读法的考核多以选择题的形式出现,今年则以开放讨论题的形式出现的居多,难度增大,分值增多。
四、知识点
考点1、化学方程式
1、定义:用化学式表示化学反应的式子,叫做化学方程式。
2、遵循原则:①要以客观事实为依据;②要遵守质量守恒定律。
考点2、化学方程式书写
(1)步骤:①写出反应物和生成物的化学式;②配平化学方程式;③注明反应条件;④检查是否需要标注“↑”或“↓”。
(2)写化学方程式时常出现的错误:
1.不尊重科学实验,随意臆造化学式或事实上不存在的化学反应。
2.不遵守质量守恒定律、没有配平或计量数不是最简比。
3.化学式书写错误。
4.写错或漏写反应条件。
5.错标或漏标“↑”(气体生成符号)、“↓”(沉淀符号)。
“↑”:如果在反应物中没有气体,而生成物中有气体,那么应该在生成气体的化学式后面标“↑”。
“↓”:在初中阶段,只有在溶液中发生反应时生成沉淀,才在生成沉淀的化学式后标“↓”。
考点3、化学方程式意义:
(1)质的方面:表明反应物、生成物和反应条件。
(2)量的方面:
①各物质间反应时的微粒个数比;
②各物质间反应时的质量比。
(质量比等于化学方程式中各物质的相对分子质量与化学计量数乘积的比。所求质量比不用约分)
考点4、化学方程式配平
在化学式前填上适当的化学计量数,使式子左、右两边的每一种元素的原子个数都相等。
1.一般情况下,可以按照“最小公倍数”法配平。
2.如果化学方程式中有单质,一般留到最后配平。
3.配平时一般从最复杂的化学式入手。但配平一氧化碳还原金属氧化物反应的化学方程式时,一般从一氧化碳入手。
4.刚开始配平,可以让化学计量数是分数。配平结束后“=”两边的化学计量数翻倍,全部变为整数即可。
5.在刚学化学方程式时,要多做一些练习以熟练配平的方法;学过一段时间之后,要试着把常见的化学方程式背下来(有的时候,上课认真听讲、课后认真写作业对背方程式很有帮助)。
考点5、化学方程式的三种读法
(1)化学方程式中的“ ”号应读成“和”,不能读成“加”;
(2)反应物和生成物中间的“=”号,应读成“生成”,不能读成“等于”。
(3)以下面的方程式为例:
2H2 O2 = 2H2O
4 : 32 : 36
1.氢气和氧气在点燃的条件下反应,生成水。
2.每2个氢分子和1个氧分子在点燃的条件下恰好完全反应,生成2个水分子。
3.每4份质量的氢气和32份质量的氧气在点燃的条件下恰好完全反应,生成36份质量的水。
,