我们学习了氧气的性质,那么氧气是怎样制取的呢?今天我们进一步学习氧气的制取,制取有两方面的内容,一方面是大量的制取叫工业制取;另一方面用于实验叫实验室制取。
考点1氧气的工业制法
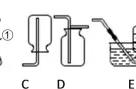
1.分离液态空气法
原理:利用液态氧气和液态氮气的沸点不同。——是物理变化
过程:

2.膜分离技术(物理变化)
制取物质时首先考虑的原料,还要考虑工艺的安全,条件,便利等方面,经过大量实验证实制取氧气时运用过氧化氢、高锰酸钾、氯酸钾相对更好一些。
考点2氧气的实验室制法
1.过氧化氢溶液(俗称“双氧水”)
(1)药品:过氧化氢溶液(主要成分H2O2)和二氧化锰(黑色粉末 MnO2)
(2)反应原理:
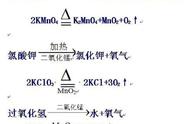
文字表达式:过氧化氢 = 水 氧气 符号表达式:H2O2 = H2O O2
注:MnO2在该反应中是催化剂,起催化作用
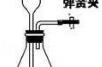
(3)装置:固液常温型

(4)注意事项:
①长颈漏斗下端管口应该伸入液面以下(液封),防止生成的气体从长颈漏斗中逸出;
②导管只需略微伸入试管塞,便于气体的导出;
③装药品时,先装固体后装液体;
④该装置的优点:可以随时添加液体。
2.氯酸钾或高锰酸钾制取氧气
(1)药品:高锰酸钾(暗紫色固体)、氯酸钾(白色固体)与二氧化锰(黑色粉末)
(2)反应原理:
文字表达式:氯酸钾 =氯化钾 氧气
符号表达式:KClO3 = KCl O2
文字表达式:高锰酸钾 锰酸钾 二氧化锰 氧气
符号表达式:KMnO4 K2MnO4 MnO2 O2
(3)装置:固体加热型(高锰酸钾加一团棉花,氯酸钾不需要加棉花)

(4)高锰酸钾制氧气的操作步骤:
① 连:连接装置,先下后上,从左到右的顺序。
② 查:检查装置气密性,将导管的一端浸入水槽中,用手紧握试管外壁,若水中导管口有气泡冒出,
松开手后,导管口出现一段水柱,证明装置不漏气。
③ 装:装入药品(药匙或纸槽)
试管口塞一团棉花,防止加热时粉末进入导气管,堵塞导管。
④ 定:固定试管时,试管口应略向下倾斜(防止生成的冷凝水回流使试管底部炸裂)
铁夹应夹在试管的中上部,导管伸入试管稍露出橡皮塞,利于产生的气体排出。
⑤ 点:加热药品,先使试管均匀受热(预热),后在固体药品部位用酒精灯外焰加热。
⑥ 收:收集气体。
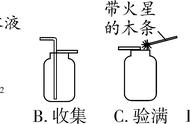
排水法收集
集气瓶装满水倒扣在水中,导管略伸进集气瓶口,当气泡连续均匀冒出时开始收集(因为开始排出的气体是空气,会使得收集的氧气不纯);当集气瓶口有大量气泡往外冒时,氧气收集满,在水下用玻璃片盖住瓶口,移出水槽,集气瓶正放在桌面上(氧气密度比空气大,正放),防止气体逸出。
向上排空气法收集
集气瓶正放在桌面上,导管应伸入集气瓶底部(为了排尽瓶内空气),验满时,将带火星的木条放在集气瓶口,若复燃,则氧气已收集满。
⑦移:先将导管移出水面
⑧熄:再停止加热
实验结束后,先将导气管移出水面,然后熄灭酒精灯,防止水槽中的水倒流回炽热的试管中,炸裂试管。
3.检验和验满
检验:用带火星的木条伸入集气瓶内,若木条复燃,说明是氧气;
验满:用带火星的木条放在集气瓶口,若木条复燃,证明已满。多功能瓶在出气口验满。