第一部分 考点研究
模板一 身边的化学物质
命题点2 氧气的制取
(时间:30分钟 分值:30分)
一、选择题
1. 下列有关氧气的制取、收集、验满、性质的实验中错误的是( )

二、填空和简答题
2. 根据如图所示装置,结合所学知识回答下列问题。

第2题图
(1)写出图中仪器①的名称:________________。
(2)实验室用A装置制取氧气,写出反应的化学方程式______________________________。
(3)实验室用B、C、E装置制取并收集干燥的氧气,则E中应盛放的试剂是____________。
(4)实验室用D装置收集氧气,当______________时开始收集。
(5)E装置中充满水时,也可以作为氧气的收集装置,则氧气应从_____(填"a"或"b")端通入。
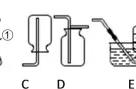
3. (2016泰州改编)同学们利用如图所示装置进行气体的制备实验(A~F为装置编号)。

第3题图
(1)写出D装置中甲仪器的名称________。
(2)用A装置加热氯酸钾和二氧化锰的混合物制取氧气,化学方程式为__________________,其中二氧化锰起____________作用;收集氧气可以选择________(填装置编号)。
(3)若用高锰酸钾制氧气,指出制取装置中明显的不足之处___________________________。
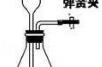
(4)制取气体前应先检查装置的气密性,若按F图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是________(填序号)。
a. 将烧杯换成水槽
b. 导管伸入水中位置过深,气体无法逸出
c. 将水换成冰水
d. 先用手捂住试管壁,再将导管另一端插入水中
4. (2016青岛)根据下列装置,回答问题:

第4题图
(1)写出图中标号仪器的名称①______________;②____________。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气时,发生反应的化学方程式为___________,从控制反应速率和节约药品的角度考虑,发生装置最好选用_______(填装置序号)。
(3)因为氧气不易溶于水,所以可以利用装置______(填装置序号)收集 。如果要做铁丝在氧气中燃烧的实验,用这种装置收集氧气时应注意____________。
5. (2015遵义)FeCl3溶液能对过氧化氢的分解起催化作用。某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响。

写出本实验发生反应的化学方程式 ____________________________________ 。
Ⅰ. 分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,如图观察到____________________ ,就可以粗略判断,得出实验结果。
为进一步判断上述实验结论的准确性,运用上图,小刚同学进行了如下实验方案设计。
Ⅱ. [方案一]在不同过氧化氢浓度下,测定收集相同体积气体所需时间。
[方案二]在不同过氧化氢浓度下,测定________________________________ 。
方案二的实验测量结果:

表中x=________ ,y________ ;
实验结论:通过测量,若V1________V2(填">"、"="或"<"),说明_______________________________________________
1. D 【解析】利用过氧化氢溶液制取氧气时不需加热,属于固液常温型,可用此发生装置,A正确;氧气的密度比空气大,可用向上排空气法收集,且导管伸入到集气瓶底部,B正确;氧气的验满是将带火星的木条放于集气瓶瓶口,若木条复燃,则已收集满,C正确;铁丝燃烧实验应事先在瓶底放一些水或少量沙子,防止燃烧后的高温熔融物溅落炸裂瓶底,D错误;故选D。
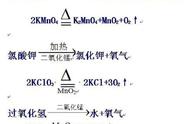
2. (1)锥形瓶 (2)2KMnO4eq \o(=====,\s\up7(△)) K2MnO4+MnO2+O2↑
(3)浓硫酸 (4)气泡连续均匀冒出 (5)b
【解析】(1)由装置图可知,仪器①的名称是锥形瓶。(2)A装置是加热固体制取气体的发生装置,且试管口放一团棉花,适合用加热高锰酸钾制取氧气,高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气。(3)浓硫酸具有吸水性,可以干燥氧气,所以要收集干燥的氧气可在E装置中盛放浓硫酸。(4)加热制取氧气时,开始排出的是试管内的空气,应该等到气泡连续均匀冒出时再收集,以防收集的氧气不纯。(5)用E装置采用排水法收集氧气时,氧气应从短管进入,使水从长管排出。
3. (1)集气瓶 (2)2KClO3eq \o(=====,\s\up7(MnO2),\s\do5(△)) 2KCl+3O2↑ 催化 D(或E) (3)试管口未放一团棉花 (4)a
【解析】(1)由图知,D装置中仪器甲是集气瓶。(2)加热氯酸钾制氧气的反应原理是氯酸钾在二氧化锰催化下,受热分解生成氯化钾和氧气,二氧化锰是该反应的催化剂,起催化作用;氧气密度比空气大,可用向上排空气法收集,氧气不易溶于水,也可用排水法收集。(3)为防止高锰酸钾粉末随气流进入导气管,应在试管口放一团棉花。(4)图F中是利用微热法检查装置的气密性,如果气密性良好,用手捂住试管,试管内温度升高,压强变大,气体从导管中逸出,在导管口观察到有气泡产生。将烧杯换成水槽只是更换盛水的容器,对是否产生气泡没有影响;如果导管伸入水中过深,水柱压强增大,可致使无气泡产生,如果水温低于室温过大,则气体一进入浸在水中的导管时,温度下降,压强变小,也可能导致无气泡产生;如果操作时先用手捂着试管,然后将导管一端插入水中,由于试管内的气体已受热逸出,导管插入水中可能观察不到气泡,故与没观察到气泡产生无关的因素是a。
4. (1)①分液漏斗 ②试管 (2)2H2O2eq \o(=====,\s\up7(MnO2)) 2H2O+O2↑ B (3)F留一些水在集气瓶瓶底
【解析】(1)图中仪器①的名称是分液漏斗,仪器②的名称是试管。 (2)实验室用过氧化氢和二氧化锰制取氧气的化学方程式为2H2O2eq \o(=====,\s\up7(MnO2)) 2H2O+O2↑,该反应是固体药品和液体药品在常温下反应,因而A、B、C装置都可以作为该反应的发生装置,但是从控制反应速率和节约药品的角度考虑,最好选择的发生装置为B装置。(3)由于氧气不易溶于水,因而可以采用排水法收集氧气;若要做铁丝在氧气中燃烧的实验,用排水法收集氧气时可在瓶内留一些水,防止加热时铁燃烧后的高温熔融物溅落下来,使集气瓶炸裂。
5. 2H2O2eq \o(=====,\s\up7(FeCl3溶液)) 2H2O+O2↑ Ⅰ.产生气泡的快慢不同
Ⅱ.在相同时间内收集到气体的体积 3 5 < 在相同氯化铁溶液催化下,过氧化氢浓度越大,分解速率越快
【解析】本实验的反应原理是过氧化氢在氯化铁溶液的催化下分解生成水和氧气,根据反应生成氧气的速率比较反应速率;由于过氧化氢分解产生氧气,所以反应中有气泡产生,可以粗略的比较反应速率;可通过比较产生气泡的快慢进行判断,如果要精确的比较反应速率,可利用图示装置,比较相同时间内产生气体的体积,或比较收集相同体积的气体所需时间;本实验的目的是探究不同浓度过氧化氢在相同浓度氯化铁溶液催化下分解的快慢比较,所以实验中需控制氯化铁溶液的浓度和收集气体所用的时间,为控制实验时氯化铁溶液的浓度,应加入等体积、等浓度的氯化铁溶液,所以表中x为3,y为5,根据相同的反应时间内生成气体的体积越大,则分解速率越快,如果V2>V1,则说明在相同浓度氯化铁溶液催化下,过氧化氢浓度越大,分解速率越快。
,