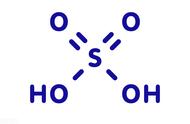
1.酸是由氢离子和酸根离子构成的化合物,如硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3),酸在水溶液中能解离出氢离子和酸根离子。
碱是由金属离子和氢氧根离子构成的化合物,如氢氧化钠(NaOH)、氢氧化钙【Ca(OH)2】、氨水(NH3·H2O),碱在水溶液中能解离出金属离子和氢氧根离子。
盐是由金属离子和酸根离子构成的化合物,如氯化钠(NaCl)、碳酸钠(Na2CO3),盐在水溶液中能解离出金属离子和酸根离子。
2.指示剂遇酸性、碱性、中性液体的变色规律:

3.下列溶液呈中性:Na2SO4溶液、 NaNO3溶液、 KNO3溶液、 K2SO4溶液、 CaCl2溶液。
4. 盐酸是无色液体,浓硫酸是无色、粘稠、油状的液体。浓盐酸有较强挥发性,将浓盐酸露置在空气中,会产生白雾,是由于浓盐酸挥发出来的氯化氢气体(HCl )跟空气中的水蒸气接触,形成盐酸小液滴的缘故。
5. 盐酸是重要的化工产品。它的主要用途有:①金属表面除锈;②制造药物(如盐酸麻黄素、氯化锌)等;③人体胃液中含有盐酸,可帮助消化。
6.硫酸是重要的化工原料。它的主要用途有:①生产化肥;②生产农药;③生产火药;④生产染料;⑤冶炼金属;⑥精炼石油;⑦金属除锈;⑧浓硫酸有吸水性,在实验室中常用它做干燥剂。
7.浓硫酸具有吸水性,能做某些气体的干燥剂。浓硫酸能干燥CO2 、H2 、 O2、 N2、SO2 、CO、CH4等,浓硫酸之所以能干燥这些气体,是因为浓硫酸不跟这些气体发生化学反应。浓硫酸能与氨气( NH3 )反应,浓硫酸不能干燥氨气( NH3 )。
8. 盐酸、硫酸都属于酸,在实验室和化工生产的酸还有硝酸(HNO3)、醋酸(CH3COOH)等。
9. 浓硫酸能将纸张、木材、布料、皮肤等物质中的氢、氧元素按水的组成脱去,这种作用通常叫做脱水作用。浓硫酸具有很强的腐蚀性,在使用时要特别注意安全。
10.浓硫酸溶于水放出大量热。如果将水注入浓硫酸,由于水的密度小,水会浮在浓硫酸上面,溶解时放出的热能使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的!在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒入浓硫酸。
11. 如果不慎将浓硫酸沾在在皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液。
2NaHCO3 H2SO4= Na2SO4 2H2O 2 CO2↑
12.硝酸、浓硫酸的氧化性很强,它们与金属反应不生成氢气。
13.稀盐酸与稀硫酸可以清除金属制品表面的锈,除锈时不能将金属制品长时间浸在酸中,如果将金属制品长时间浸在酸中,铁锈被除去后,铁钉表面就会冒出气泡,这是因为铁与酸发生反应。
14. 酸有一些相似的化学性质(可单条背记)
①酸能使紫色石蕊溶液变红,使无色酚酞溶液不变色
②酸能跟多种活泼金属反应,生成盐和氢气
注意: 因硝酸、浓硫酸的氧化性很强,它们与金属反应不生成氢气。
③ 酸可以与某些金属氧化物反应生成盐和水
Fe2O3 6HCl=2FeCl3 3H2O
Fe2O3 3H2SO4=Fe2(SO4 )3 3H2O
CuO 2HCl= CuCl2 H2O
CuO H2SO4 = CuSO4 H2O
Na2O 2HCl= 2NaCl H2O
Na2O H2SO4= Na2SO4 H2O
④酸能和某些盐反应生成新的盐和新的酸
HCl AgNO3 = AgCl↓ HNO3
H2SO4 BaCl2 = BaSO4↓ 2HCl
注意:AgCl、BaSO4既不溶于水,也不溶于稀盐酸、稀硝酸
⑤酸能与碱反应生成盐和水
Cu(OH)2 H2SO4 = Cu SO4 2H2O
Cu(OH)2 2HCl=CuCl2 2H2O
15. NaOH是白色固体,极易溶于水,溶于水放出热量。NaOH俗名叫苛性钠、火碱或烧碱。氢氧化钠有强烈的腐蚀性。如果不慎将氢氧化钠溶液沾到皮肤上,先用较多的水冲洗,再涂上硼酸溶液。
16. 氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐步溶解,这种现象叫潮解。根据氢氧化钠易潮解的性质,可用氢氧化钠作某些气体的干燥剂,氢氧化钠可以干燥O2、CO、CH4、H2、NH3 ,但不能干燥CO2、SO2 。
17.NaOH的用途主要有:①氢氧化钠是一种重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等。②氢氧化钠能与油脂反应,在生活中可用来去除油污,如炉具清洁剂中含有氢氧化钠。
18. Ca(OH)2是一种白色粉末状固体,俗称熟石灰或消石灰。对皮肤和衣服有腐蚀作用,使用时应小心。Ca(OH)2微溶于水,其水溶液俗称石灰水;当石灰水中存在较多未溶解的熟石灰时,就称为石灰乳或石灰浆。
19. 氢氧化钙的用途:①建筑上用熟石灰与沙子混合来砌砖,用石灰浆粉刷墙壁;②在树木上涂刷含有硫磺粉等的石灰浆,可保护树木,防止冻伤,并防止害虫生卵;③农业上可用石灰乳与硫酸铜等配制成具有*菌作用的波尔多液作为农药使用;④熟石灰还可用来改良酸性土壤。
20.怎样鉴别石灰水和氢氧化钠溶液?
分别取1~2mL(或少量 )未知溶液于试管中,向试管中通入CO2气体,出现白色沉淀的原溶液是石灰水,没有变化的原溶液就是氢氧化钠溶液。
有关化学反应化学方程式为:
Ca(OH)2 CO2=CaCO3↓ H2O
2NaOH CO2 = Na2CO3 H2O
21.碱有一些相似的化学性质(可单条背记)
①碱溶液能使紫色石蕊溶液变蓝,是无色酚酞溶液变红
注意:Cu(OH)2、Fe (OH)3等不溶性碱不能使紫色石蕊溶液和酚酞溶液变色
② 碱能跟多数非金属氧化物起反应,生成盐和水
Ca(OH)2 CO2 =CaCO3↓ H2O
2NaOH CO2 = Na2CO3 H2O
2NaOH SO2 = Na2SO3 H2O
2NaOH SO3 = Na2SO4 H2O
③ 碱溶液跟某些盐溶液起反应,生成另一种盐和另一种碱
2NaOH CuSO4= Cu(OH)2↓ Na2SO4
3NaOH FeCl3= Fe (OH)3↓ 3NaCl
注意:参加反应的碱和盐必须均能溶于水。
④碱和酸反应生成盐和水
Cu(OH)2 H2SO4 = Cu SO4 2H2O
Cu(OH)2 2HCl=CuCl2 2H2O
22.即在不同的酸溶液中都含有H ,所以酸有一些相似的化学性质。
在不同的碱溶液中都含有OH-,所以碱也有一些相似的化学性质。
23. 酸碱盐的酸碱性
①酸溶液一定呈酸性,碱溶液一定呈碱性,盐溶液不一定呈中性。
有的盐溶液呈中性,如NaCl、K Cl、CaCl2、NaNO3、KNO3、Ca(NO3)2、Na2SO4 、K 2SO4 等盐溶液
有的盐溶液呈碱性,如 Na2CO3、K 2CO3、NaHCO3、KHCO3等盐溶液
有的盐溶液呈酸性,如 硫酸氢钠(NaHSO4)等盐溶液
②碱溶液一定呈碱性,但显碱性的不一定是碱。
酸溶液一定呈酸性,但显酸性的不一定是酸。
24. 部分酸、碱、盐的溶解性口诀
钾钠铵盐硝盐溶
盐酸盐不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐可溶钾钠铵
酸类多数可溶解
碱类可溶钾钠钡
25.HCl NaOH =NaCl H2O、2HCl Ca(OH)2=CaCl2 2H2O、H2SO4 2NaOH=Na2SO4 2H2O、H2SO4 Ca(OH)2=Ca SO4 2H2O,上述酸和碱作用生成盐和水的反应,叫做中和反应。
26. 中和反应的实质:H OH-= H2O
27.中和反应在实际中的应用。①在农业生产中,农作物对土壤的酸碱性有一定的要求。可利用中和反应,在土壤中加入酸性或碱性物质,调节土壤的酸碱性,②处理工厂的废水:如硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理;印染厂的废水呈碱性,可加入硫酸进行中和。③胃酸过多的病人可以服用含有碱性物质(如氢氧化铝)的药物,以中和过多的胃酸。
28. ①溶液的酸碱性强弱程度,即溶液的酸碱度。②溶液酸碱度常用PH来表示。③PH的范围通常为0-14。④测定PH最简便的方法是使用PH试纸。⑤用PH试纸测定溶液的PH的方法是:在白瓷板或玻璃片上放一小片PH试纸,用玻璃棒蘸取溶液滴到PH试纸上,把试纸显示的颜色与标准比色卡比较,即可得出溶液的PH。
注意:不能将PH试纸浸入待测液中,否则会污染待测液。
29. 酸性溶液的PH<7 ,PH越小酸性越强;碱性溶液的PH>7,PH越大碱性越强;中性溶液的PH=7 。
30. 了解溶液酸碱度重要意义:①化工生产中许多反应必须控制在一定PH范围内;②农作物适宜在PH为7或接近7的土壤中生长,测定土壤的PH可以知道土壤是否适于种植;③测定雨水的PH,可以了解空气的污染情况;④测定人体内或排出的液体的PH,可以帮助人们了解人体的健康状况。
31. 正常雨水的pH约为5.6(因为溶有CO2),pH<5.6的雨水为酸雨。

扫描下方二维码加关注
,